Innledning
Generell anestesi består av legemidler som gir søvn, analgesi og eventuelt muskelavslapning. I mange tilfeller er det tilstrekkelig at pasientene sover og er smertefrie under prosedyren, mens andre ganger er det i tillegg behov for muskelrelakserende medikamenter (1).
Muskelrelaksantia omtales også som nevromuskulære blokkere (NMB) og brukes for å legge til rette for endotrakeal intubasjon og kirurgi. Legemidlene gir en nevromuskulær blokade av skjelettmuskulatur som medfører at muskulaturen undertrykker frivillige eller reflektoriske bevegelser på smerte og stimuli. Det siste er viktig i forbindelse med enkelte inngrep der pasienten ikke bør bevege på seg. Muskelrelakserende legemidler brytes ned etter en viss tid, enten spontant eller ved administrering av legemidler som opphever effekten. Den nevromuskulære blokaden må være reversert før pasienten skal vekkes fra generell anestesi. Muskelrelakserende legemidler har ulik virkningsmekanisme og eliminasjon, derfor vil tidspunkt for muskelgjenvinning og egnet tidspunkt for ekstubasjon variere (2,3).
Pasienter som fortsatt er påvirket av muskelrelakserende legemidler etter ekstubasjon betegnes som restkurarisert. Dette er en uønsket effekt som kan medføre ulike postoperative komplikasjoner. Symptomer på restkurarisering er muskelsvakhet, svekkelse av respirasjon med lavere tidalvolum og respirasjonsfrekvens, svakere reflekser i luftveiene og svelgvansker. Selv minimal restkurarisering er ugunstig og ubehagelig for pasienten og kan medføre hypoventilasjon, lungekomplikasjoner, regurgitasjon og aspirasjon (4–7). Dette er tilstander som kan forlenge pasientens opphold i postoperativ avdeling og sykehus. Tidligere studier rapporterer stor variasjon i forekomst av restkurarisering hos postoperative pasienter, fra 4 til 88 prosent (7–9).
Bruk av kliniske tegn, som at pasienten beveger på seg, klemmer hånden eller løfter hodet, har vært de vanlige måtene å vurdere om pasienten er restkurarisert. I litteraturen er det god dokumentasjon på at kliniske tegn og vurderinger ikke er tilstrekkelig for å vurdere om en nevromuskulær blokade er tilfredsstillende opphevet. De kliniske tegnene viser at muskelkraften er tilbake, og at den nevromuskulære blokaden ikke er dyp (2,3,6).
Nevromuskulær blokade kan monitoreres ved bruk av det non-invasive måleinstrumentet train-of-four (TOF) (3,6,9–11). TOF gir en elektrisk stimulering av en motorisk nerve, som igjen kan gi kontraksjon av muskelen nerven forsyner. Kontraksjonene registreres av en akselerasjonstransducer som er festet på tommelen. Måleinstrumentet gir en tallverdi som mål for blokaden (2,3,6). Ved den siste revisjonen av Norsk standard for anestesi (NSA) i 2016 ble ordlyden endret fra «anbefaler» til «bør» bruke nevromuskulær monitorering når ikke-depolariserende NMB administreres (12). En ny revisjon er ute på høring, der forslaget er at pasientene «skal» monitoreres når det brukes NMB (13).
Bakgrunnen for utvikling av denne prosedyren var at både leger og sykepleiere ved den aktuelle anestesiavdelingen oppga at de var usikre på dosering av legemidler for reversering av nevromuskulær blokade, spesielt etter lange inngrep der pasienten hadde fått gjentatte doser av muskelrelakserende legemidler. De ansatte opplevde at praksis var variert i avdelingen med hensyn til monitorering av nevromuskulær blokade. Ved noen seksjoner ble det alltid gitt legemidler for reversering av nevromuskulær blokade, uavhengig av bruk av nevromuskulær monitorering, mens ved andre seksjoner ble pasientenes nevromuskulære blokade monitorert gjennom hele forløpet.
På bakgrunn av dette var det et behov for å utarbeide en kunnskapsbasert prosedyre for nevromuskulær monitorering og dosering av legemidler for reversering av nevromuskulær blokade.
Metode
For å strukturere prosessen med kvalitetsarbeidet brukte vi Kunnskapssenterets modell for kvalitetsforbedring (figur 1) (14), samt Helsedirektoratets «Veileder for utvikling av kunnskapsbaserte retningslinjer» (15). Kvalitetsvurdering av fagprosedyren ble utført med verktøyet AGREE II (16).
Kunnskapsbasert praksis
Kunnskapsbaserte prosedyrer er et viktig tiltak for å øke sikkerhet og kvalitet på pasientbehandlingen. Forskningsbasert kunnskap alene er ikke tilstrekkelig for å ta beslutninger, men må brukes dynamisk sammen med erfaringer fra praksis og etiske vurderinger. I tillegg må det tas hensyn til pasientens preferanser, som vist i modellen for kunnskapsbasert praksis i figur 2 (17).

Brukerkunnskap og brukermedvirkning
Brukermedvirkning innebærer at pasientens behov og ønsker skal vektlegges i behandlingen og legge til rette for at pasienten selv kan ta velinformerte valg der det er aktuelt (18). Prosjektgruppen vurderte det slik at brukermedvirkning ikke var relevant for denne prosedyren av praktiske årsaker. Vi har imidlertid vektlagt at brukerperspektivet er ivaretatt ved at prosedyren skal sikre forsvarlig behandling av god kvalitet for pasienten.
Erfaringsbasert kunnskap
En prosjektgruppe bestående av fire anestesileger og seks anestesisykepleiere ble opprettet for å utvikle prosedyren. Klinisk anestesierfaring hos medlemmene var mellom 10–25 år. Gruppen gjennomgikk forskningslitteraturen som er grunnlaget for prosedyren. Ved utarbeidelse av prosedyren ble erfaringskunnskap fra både medarbeidere i avdelingen og medlemmene i prosjektgruppen vurdert og inkludert i prosedyrens innhold.
Førsteforfatter kontaktet også andre sykehus med forespørsel om de hadde prosedyrer som var relevante for overvåkning og reversering av nevromuskulær blokade. Ingen av sykehusene vi kontaktet hadde utarbeidet kunnskapsbaserte prosedyrer.
Litteratursøk
Det ble gjennomført systematiske litteratursøk veiledet av bibliotekar i databasene UpToDate, National Guideline Clearinghouse, The Cochrane Library, Epistemonikos, Ovid, SweMed+ og PubMed og i retningslinjedatabasene BMJ Best Practice, NICE Guidance, Nasjonale retningslinjer fra Helsedirektoratet og Nasjonalt nettverk for fagprosedyrer. I tillegg utførte vi manuelle søk i artiklenes referanselister.
Søkeordene «patient», «general anesthesia», «neuromuscular blocking agent», «train-of-four (TOF)», «residual neuromuscular blocade», «neuromuscular blocking agent reversal» sammen med Medical Subjest Headings termer (Mesh) ble brukt hver for seg og i ulike kombinasjoner. Inklusjonskriteriene var litteratur fra etter år 2000, samt engelsk eller skandinavisk språk. Konteksten var ekstubasjonsfasen.
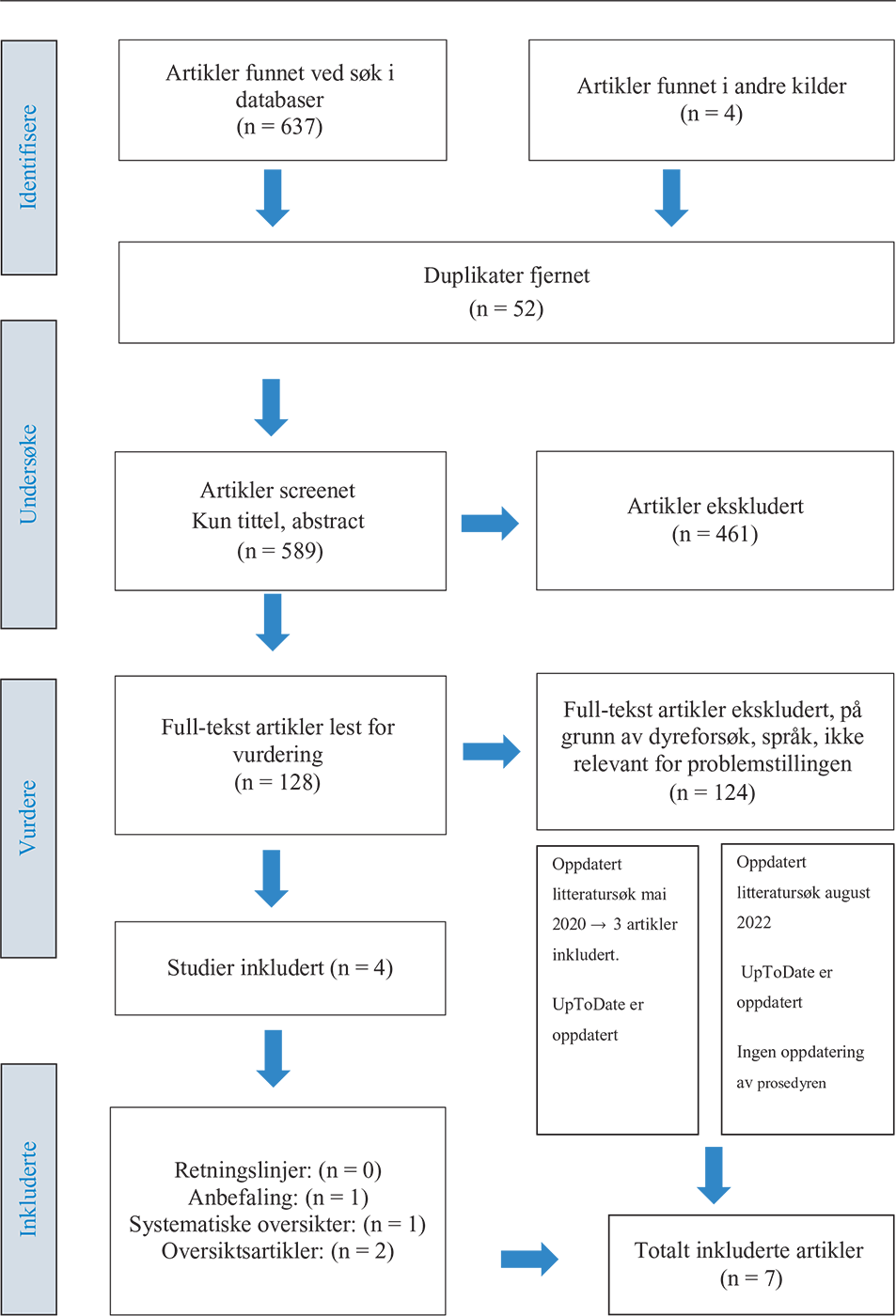
To medlemmer av prosjektgruppen utførte en manuell seleksjon av identifiserte artikler (641) med hensyn på duplikater (52 ekskludert). Etter utvelgelse på bakgrunn av tittel og abstrakter (461 ekskludert) ble 128 artikler gjennomgått med full-tekstlesing av prosjektgruppens medlemmer der vi så på relevans for retningslinjen (124 ekskludert). Det var konsensus i gruppen om hvilke artikler som ble ekskludert. Oversikt over eksklusjonskriterier presentert i tabell 1. Dette resulterte i inklusjon av fire artikler (2,6,9,11) som vist i prismadiagram, figur 3.
| Kontinuerlig infusjon med muskelrelaksantia | Eldre pasienter
Overvektige pasienter |
| Neostigmin med andre styrker enn 50 microgr/ml
Neostigmin/atropin |
Elektrolyttforstyrrelser, medisinske tilstander og legemidler/interaksjoner som kan innvirke på virketid/effekt og eliminasjon av muskelrelaksantia og reverserende legemidler |
| EMG (electromyography), MMG (mechanomyography), TOF Watch | Rapid sequence induction (RSI) |
Etter et oppdatert litteratursøk i mai 2020 ble tre nye artikler inkludert i prosedyrens kunnskapsgrunnlag (3,19,20). I tillegg var artikkelen fra UpToDate oppdatert siden forrige litteratursøk (2). Det oppdaterte søket resulterte i at prosedyren ble revidert med en endring knyttet til TOF-verdi og reversering med neostigmin, og videre at sugammadex kan brukes med forsiktighet til barn under 2 år. Det ble også tillagt et informasjonsskriv tiltenkt kvinner og unge jenter i fertil alder ettersom sugammadex kan ha innvirkning på effekten av hormonelle prevensjonsmidler (2,21).
Det ble gjennomført et nytt systematisk litteratursøk i august 2022. Dette søket ga ikke grunnlag for endring av prosedyren.
Kildekritikk
Kvalitetssikring av studiene ble gjennomført av prosjektgruppens medlemmer. Vi brukte Grading of Recommendations Assessment, Development and Evaluation (GRADE) (22), eller der det var relevant ut fra studiedesign, en sjekkliste for vurdering av oversiktsartikler (23).
Artikkelen fra UpToDate (2) er en anbefaling vurdert som GRADE 2B. Dette tilsvarer en svak anbefaling, der tiltakene ikke nødvendigvis skal brukes på alle pasienter (22).
Artikkelen til Claudius og Viby-Mogensen (2008) (11) oppfyller sjekklisten for vurdering av oversiktsartiklers krav på stort sett alle punkter og anses som valid.
Felles for to av oversiktsartiklene (6,9) er manglende metodisk kvalitet ut fra sjekklistene. De er ikke systematiske og har ikke oppgitt inklusjon, søkestrategi eller hvilke databaser det er søkt i. Forfatterne har selv valgt ut studier til artikkelen. Resultatene kan dermed ikke vektlegges like tungt som ved en systematisk oversikt. Artiklene oppfyller dermed ikke alle kravene i sjekklisten for oversiktsartikler, men de er av nyere dato, forfatterne er regnet som spesialister innen dette fagfeltet og artiklene er publisert i anerkjente tidsskrifter. De aktuelle forfatterne har publisert flere betydelige artikler og oppfattes som ledende i fagsammenhenger. Artiklene har oversiktlig gjennomgang av tema, basert på flere relevante randomiserte kontrollerte studier (RCT).
Resultat
Presentasjon av kunnskapsgrunnlaget for fagprosedyren
Prosedyrens kunnskapsgrunnlag består av en kunnskapsoppsummering med anbefalinger fra UpToDate (2), en retningslinje (3) og fem oversiktsartikler hvorav to var systematiske oversiktsartikler (6,9,11,19,20).
Monitorering av nevromuskulær blokade er viktig for pasientsikkerheten
Kunnskapsgrunnlaget viser at TOF bør være ≥ 90 prosent før pasienten ekstuberes. Ved TOF < 90 prosent kan det fortsatt være muskelsvekkelse av øvre luftveismuskler/farynks og øvre øsofagus, og hypoksiresponsen kan være redusert (2,3,6,11).
En studie sammenlignet bruk av TOF mot kliniske vurderinger av muskelblokade. Studien fant at TOF-monitorering avdekket restkurarisering hos 64 prosent av pasientene som ut fra kliniske vurderinger ble vurdert til ikke å være restkurarisert (24).
Anbefalte monitoreringssteder
Ved bruk av TOF er «gullstandarden» stimulering av ulnarnerven og kvantitativ nevromuskulær monitorering av muskelen adductor pollicis. Denne muskelen gir mest nøyaktig måling fordi den gjenspeiler sentrale muskler (9,11). I de tilfeller armen ikke er tilgjengelig eller kan ligge fritt peroperativt, kan fot eller ansikt være et alternativ. Det anbefales imidlertid å flytte monitoreringen til armen og adductor pollicis så snart den er tilgjengelig igjen (2,6,9). TOF-responsen gjenopprettes raskere ved øyemusklene enn ved adductor pollicis, derfor kan forekomsten av restkurarisering være høyere ved monitorering av øyemuskler. Dette underbygges av en studie som viste til restkurarisering hos 22 prosent og 52 prosent av pasientene ved monitorering av henholdsvis adductor pollicis og øyemusklene (25).
Studiene anbefaler å være observant på apparatets innstilte strømstyrke, avhengig av hvilket målested som brukes og om det er barn eller voksne pasienter. Ved kalibrering kan strømstyrken bli tilpasset i forhold til motstand på målested, men dette er det ikke enighet om i litteraturen. Flere studier sår tvil om det er nødvendig med kalibrering og måling av referanseverdi, da det er lite evidens om påstanden (6,26).
Ulike monitoreringsmetoder
Det er ulike måleapparat av TOF, men det vanligste i klinisk bruk i dag er akselerometer (AMG) (2,6).
De siste årene har måleapparatet elektromyografi (EMG) kommet på markedet og en studie sammenligner utfall av akselerometer og elektromyografi (27). Fordelen med det nye måleapparatet EMG er at elektroden som brukes ikke er avhengig av at tommelen har fri bevegelse.
Anbefalinger for reversering
Det er to muligheter for å reversere effekten av den nevromuskulære blokaden, enten medikamentelt eller ved at medikamentet brytes ned spontant etter en viss tid og pasienten gjenvinner muskelkraften. For medikamentell reversering anvendes legemidlene neostigmin eller sugammadex (2,3).
Mange av de identifiserte studiene i litteratursøket ser på ulike doseringer av neostigmin og ved hvilke TOF-verdier legemiddelet blir administrert ved. Det vises til dosering av neostigmin med 0,05 mg/kg ved TOF ≥ 4, og 0,025 mg/kg ved TOF 70–90 prosent (28).
Sugammadex kan raskt reversere en blokade uansett TOF-verdi når den nevromuskulære blokaden er indusert med rocuronium eller vecuronium (2,3,7). Produsenten anbefaler dosering med sugammadex 4 mg/kg ved TOF < 1, og 2 mg/kg ved TOF ≥ 2 (28). Studier viser at sugammadex kan ha innvirkning på effekten av hormonelle prevensjonsmidler, noe som er aktuelt hos kvinner i fertil alder (2,21).
Monitorering og reversering til barn
Litteratursøket identifiserte få studier som omhandlet monitorering og reversering til barn. Neostigmin har vært kjent brukt som reversering til barn i lang tid, og kan brukes til barn i alle aldre uansett hvilket ikke-depolariserende NMB som er gitt. Produsenten anbefaler sugammadex til barn over 2 år. Det er flere publiserte kasuistikker som rapporterer tilfredsstillende bruk av sugammadex til barn under 2 år (29). Liu et al. (20) viste at sugammadex gir raskere reversering og tid til ekstubasjon hos barn sammenlignet med neostigmin eller placebo. Bivirkninger er tilnærmet de samme som ved neostigmin, men studiene viser at det er færre tilfeller av bradykardi med sugammadex.
Erfaringsgrunnlaget i prosedyren
Det var viktig for prosjektgruppen at prosedyren skulle være tilpasset en klinisk hverdag og hva som er økonomisk hensiktsmessig, uten at det påvirket pasientsikkerhet.
Medlemmene i prosjektgruppen hadde erfaring med at mangelfullt utstyr og prosedyrer resulterte i ulik praksis i bruk av TOF og reversering i avdelingen. En tidligere studie fra en operasjonsavdeling hvor utforming og bruk av en fagprosedyre i kvantitativ TOF ble implementert etter systematisk opplæring, viste at bruken av nevromuskulær monitorering økte og forekomsten av restkurarisering ble redusert (30). I vår avdeling erfarte vi større forståelse for hvordan nevromuskulær monitorering skulle utføres etter at prosedyren med illustrasjoner som viser plassering av elektroder ble implementert.
Siden neostigmin er et rimeligere alternativ enn sugammadex anbefaler prosedyren derfor neostigmin ved mindre omfattende blokader (TOF ≥ 4) (3). Videre har vi satt doseringen av sugammadex til anbefalt dosering fra produsent både for barn over to år og voksne pasienter (28,31).
Prosedyrens dosering av sugammadex til barn < 2 år er kvalitetssikret ut fra forskningsartiklene, et anerkjent medisinsk oppslagsverk og erfaringer fra praksis (19,20,32–34).
Implementering
Implementering er viktig i prosesser som omhandler tiltak for kvalitetsforbedring. Målet med prosessen er å endre praksis og skape vedvarende forbedringer av behandlingen som ytes (15).
Prosedyren ble sendt ut på høring til tre andre sykehusavdelinger før den ble innført i vår anestesiavdeling. Tilbakemeldinger fra høringsrunden resulterte i små endringer i struktur.
Det ble gjennomført internundervisning om prosedyren for personalet og den ble innlemmet i sykehusets e-håndbok (31). Papirutgave av prosedyren ble gjort tilgjengelig i prosedyreperm på enkelte operasjonsstuer. Siden prosedyren er omfattende, ble det utarbeidet et vedlegg med en kortversjon av de viktigste punktene til bruk i den kliniske hverdagen. Prosedyren ble også publisert på www.helsebiblioteket/fagprosedyrer.no.
Vi har erfart at flere at personalet anvender TOF mer regelmessig etter at prosedyren ble implementert. Et viktig tiltak var at det også ble kjøpt inn flere nervestimulatorer til operasjonsstuene. TOF-modulen ble integrert i overvåkningsenheten, noe som medførte automatisk overføring og dokumentasjon av TOF-verdi til elektronisk pasientjournal. Dette bidrar til mer nøyaktig dokumentasjon.
Vi har imidlertid mangelfull kjennskap til om personalet doserer reverserende legemidler tilpasset pasientens TOF-verdi. Pasienters individuelle metabolisme for de ulike legemidlene gjør at vi ikke kan basere evalueringen av nevromuskulær blokade på tidsaspektet og kliniske vurderinger etter siste administrerte dose av muskelrelaksantia. Etter at prosedyren ble innført erfarte vi at brukerne oftere benytter TOF-verdien for individuell dosering av legemidler for reversering. Vi ser videre at det er et behov for å evaluere om retningslinjen har bidratt til forbedring i pasientbehandlingen.
Et viktig bidrag i arbeidet var at vi hadde opprettet en tverrfaglig gruppe bestående av leger og sykepleiere for å utarbeide prosedyren. Vi hadde jevnlige prosjektmøter hvor tiltak som ble foreslått ble vurdert i prosjektgruppen før vi kom frem til enighet. Slik oppnådde vi kunnskapsutveksling i prosjektgruppa, og økt interesse for å utarbeide en fagprosedyre. Det at begge yrkesgruppene som skal bruke prosedyren var representert i prosjektgruppen, var en stor fordel når prosedyren skulle implementeres.
Viktighet av å revidere prosedyren underveis
Vi har ikke evaluert prosedyren etter at den er tatt i bruk, som er trinn fire i kvalitetsforbedringsmodellen (14). Vi har mottatt noen tilbakemeldinger på strukturen av prosedyren som vil bli vurdert av prosjektgruppen på evalueringstidspunktet tentativt høsten 2023.
Utfordringen har vært å nå ut til brukerne med informasjon om oppdateringer underveis i prosessen. Prosedyren er oppdatert i sykehusets e-håndbok, men www.helsebiblioteket/fagprosedyrer.no er ikke lenger tilgjengelig for oppdatering av prosedyrer.
Hva har vi valgt å gjøre med monitorering og reversering av nevromuskulær blokade ved generell anestesi til barn?
Ved TOF-monitorering av barn forholder vi oss til anbefalinger for bruk av måleinstrumentet i vår avdeling, som er NMT Phillips Intellivue module 865383. Måleinstrumentet har en nedre aldersgrense på ett år, og produsenten anbefaler monitorering på arm med strømstyrke 20–30 mA. Til gjengjeld kan ett av de nyere måleinstrumentene med EMG brukes på barn fra en måneds alder og nedre vektgrense på 4,5 kg. Dette kan kanskje være en løsning på en bedre overvåkning av nevromuskulær blokade hos små barn.
Reversering med neostigmin og sugammadex følger tilsvarende doseringer som hos voksne, men det vektlegges administrering av sugammadex med forsiktighet til barn under 2 år.
Konklusjon
Hensikten med dette kvalitetsarbeidet var å utarbeide en kunnskapsbasert fagprosedyre for monitorering og reversering av nevromuskulær blokade.
Prosedyren kan bidra til en mer kunnskapsbasert vurdering av muskelblokade og reversering i klinisk praksis og samtidig føre til økt pasientsikkerhet og bedre kvalitet i pasientbehandlingen.
Vårt inntrykk er at implementering av denne kunnskapsbaserte fagprosedyren har medført økt bevissthet for restkurarisering og økt bruk av TOF-monitoreringsutstyr under generell anestesi med muskelrelaksantia i vår anestesiavdeling.

Referanser
- 1. Lian S, Næss T. Farmakologi – forståelse og klinisk utøvelse. I: Leonardsen, AC, red. Anestesisykepleie. 3. utg. Oslo: Cappelen Damm; 2021. s. 121–163.
- 2. Brull SJ, Renew JR, Naguib M, Joshi GP, Crowley M. Monitoring neuromuscular blockade [Internett]. USA: UpToDate; 2017 [oppdatert 10.januar 2020; hentet 1.mai 2020]. Tilgjengelig fra: https://www.uptodate.com/contents/monitoring-neuromuscular-blockade
- 3. Plaud B, Baillard C, Bourgain J-L, Bouroche G, Desplanque L, Devys J-M. et al. Guidelines on muscle relaxants and reversal in anaesthesia. Anaesth Crit Care Pain Med. 2020;39:125–142.
- 4. Heier T. Muskelrelakserende midler. Tidsskrift for Den norske legeforening. 2010; 130.
- 5. Plaud P, Debaene B, Donati F, Marty J. Residual paralysis after emergence from anesthesia. Anesthesiology. 2010;112(4).
- 6. Brull SJ, Kopman A. Current status of neuromuscular reversal and monitoring. Anesthesiology. 2017;126(1).
- 7. Grosse-Sundrup M, Henneman JP, Warren S, Sandberg WS, Bateman BT, Uribe JV. Intermediate acting non-depolarizing neuromuscular blocking agents and risk and postoperative respiratory complications: prospective propensity score matched cohort study. BMJ. 2012;345:e6329.
- 8. Schaller SJ, Lewald H. Clinical pharmacology and efficacy of sugammadex in the reversal of neuromuscular blockade. Expert Opin Drug Metab Toxicol. 2016;12(9).
- 9. Thilen SR, Bhananker SM. Qualitative neuromuscular monitoring: how to optimize the use of a peripheral nerve stimulator to reduce the risk of residual neuromuscular blockade. Curr Anesthesiol Rep. 2016;6.
- 10. Kopman AF. Neuromuscular monitoring: old issues, new controversies. J Crit Care. 2009;24(1).
- 11. Claudius C, Viby-Mogensen J. Acceleromyography for use in scientific and clinical practice. Anesthesiology. 2008;108(6).
- 12. Norsk anestesiologisk forening (NAF) & Anestesisykepleiernes Landsgruppe av NSF (ALNSF). Norsk standard for anestesi [Internett]. Oslo: Norsk anestesiologisk forening & Anestesisykepleiernes landsgruppe av NSF; 2016 [hentet 1. mai 2020]. Tilgjengelig fra: http://nafweb.no/standarder/standard-for-anestesi/
- 13. Norsk anestesiologisk forening (NAF) & Anestesisykepleiernes Landsgruppe av NSF (ALNSF). Høring Norsk standard for Anestesi [Internett]. Oslo: Norsk anestesiologisk forening & Anestesisykepleiernes landsgruppe av NSF: 2022 [hentet 20. januar 2023]. Tilgjengelig fra: https://www.nafweb.no/nyheter/horing-norsk-standard-for-anestesi
- 14. Modell for kvalitetsforbedring [Internett]. Oslo: Helsebiblioteket; 2015 [hentet 20. juni 2017]. Tilgjengelig fra: http://www.helsebiblioteket.no/kvalitetsforbedring/metoder-og-verktoy/modell-for-kvalitetsforbedring
- 15. Veileder for utvikling av kunnskapsbaserte retningslinjer. Veileder IS-18709. Direktoratet [Internett]. Oslo: Helsedirektoratet; 2012 [hentet 20. juni 2017]. Tilgjengelig fra: https://helsedirektoratet.no/retningslinjer/veileder-for-utvikling-av-kunnskapsbaserte-retningslinjer
- 16. Appraisal of Guidelines for research & evaluation II (AGREE II) [Internett]. Oslo: The AGREE Collaboration & Sosial – og helsedirektoratet; 2003 [hentet 20. juni 2018]. Tilgjengelig fra: http://www.agreetrust.org/wp-content/uploads/2013/06/AGREE_Instrument_Norwegian.pdf
- 17. Kunnskapsbasert praksis [Internett]. Oslo: Helsebiblioteket; 2017 [hentet 20. september 2020]. Tilgjengelig fra: http://www.helsebiblioteket.no/kunnskapsbasert-praksis
- 18. Nortvedt MW, Jamtvedt G, Graverholt B, Nordheim LV, Reinar LM. Jobb kunnskapsbasert! En arbeidsbok. 2. utg. Oslo: Akribe; 2012.
- 19. Grigg E. Sugammadex and neuromuscular reversal: special focus on neonatal and infant populations. Anesthesiology. 2020;33(3).
- 20. Liu G, Wang R, Yan Y, Fan L, Xue J, Wang T. The efficacy and safety of sugammadex for reversing postoperative residual neuromuscular blockade in pediatric patients: A systematic review. Scientific Reports. 2017;(7):5724.
- 21. Williams R, Bryant H. Sugammadex advice for woman of childbearing age. Anaesthesia. 2017;73(1):133–134.
- 22. GRADE (The Grading of Recommendations Assessment, Development and Evaluation). GRADE Working Group [Internett]. 2012 [hentet 20. juni 2017]. Tilgjengelig fra: http://gradeworkinggroup.org
- 23. Kunnskapssenteret. Sjekkliste for vurdering av en oversiktsartikkel [Internett]. Oslo: Kunnskapssenteret; 2017 [hentet 20. juni 2017]. Tilgjengelig fra: http://www.kunnskapssenteret.no/verktoy/sjekklister-for-vurdering-av-forskningsartikler
- 24. Fortier L-P, McKeen D, Turner K, Warriner B, Jones PM, Chaput A, et al. The RECITE Study: A Canadian prospective, multicenter study of the incidence and severity of residual neuromuscular blockade. Anesth Analg. 2015;121(2).
- 25. Thilen SR, Hansen BE, Ramaiah R, Kent CD, Treggiari MM, Bhananker SM. Intraoperioperative neuromuscular monitoring site and residual paralysis. Anesthesiology. 2012;117:(5).
- 26. Naguib M, Brull SJ, Johnson KB. Conceptual and technical insights into the basis of neuromuscular monitoring. Anaesthesia. 2017;72(Suppl.1):16–37.
- 27. Bowdle A, Bussey L, Michaelsen K, Jelacic S, Togashi K, et al. A comparison of a prototype electromyograph vs. a mechanomyograoh and an acceleromyograph for assessment of neuromuscular blockade. Anaesthesia. 2020;75(2):187–195.
- 28. Felleskatalogen [Internett]. Oslo: Felleskatalogen: 2020 [hentet 20. januar 2020]. Tilgjengelig fra: https://www.felleskatalogen.no/medisin
- 29. Franz AM, Chiem J, Martin LD, Rampersad S, Phillips J, Grigg E. Case series of 331 cases of sugammadex compared to neostigmine in patients under 2 years of age. Pediatr Anesth. 2019; 29:591–596.
- 30. Todd MM, Hindman BJ, King BJ. The implementation of quantitative electromyographic neuromuscular monitoring in an academic anesthesia department. Anesth Analg. 2014;119;(2): 323–31.
- 31. Anestesi-Train-of-four (TOF) monitorering og reversering av nevromuskulær blokade [Internett]. Oslo: ehåndboken.ous-hf.no; 2020 [hentet 20. juni 2020]. Tilgjengelig fra: https://www.eHåndbok - Anestesi - Train-of-four (TOF) monitorering og reversering av nevromuskulær blokade (ous-hf.no)
- 32. Hristovska AM, Duch P, Allingstrup L, Afshari A. Efficacy and safety of sugammadex versus neostigmine in reversing neuromuscular blockade in adults. Cochrane Database Syst Rev. 2017;14;8:CD012763.
- 33. Won JW, Lim BG, Lee DK, Kim H, Kong MH, Lee IO. Sugammadex for reversal of rocuronium-induced neuromuscular blockade in pediatric patients. A systematic review and meta-analysis. Medicine. 2016;95:34(e4678).
- 34. Shann F. Drug Doses.17. utg. Australia: Department of Paediatrics University of Melbourne; 2017.