Innledning
Samtidig som stadig flere overlever akutt og kritisk sykdom som krever intensivbehandling, har det også blitt fremtredende at denne gruppen sliter med redusert daglig funksjon og redusert livskvalitet som følge av gjennomgått sykdom og intensivbehandling (1). Studier viser at mellom 30 og 50 prosent av alle intensivpasienter får redusert fysisk funksjon i form av intensive care unit acquired weakness (ICUAW) (2). ICUAW er en samlebetegnelse på diagnoser som skyldes muskelsvakhet eller nevropati som følge av intensivbehandling (2). Både critical illness polyneuropathy, critical illness myopathy, muskelatrofi og redusert muskelcellefunksjon er blant tilstandene som omfattes av ICUAW (3,4). Denne diagnosen representerer en betydelig komplikasjon for pasientene som blir rammet. De fleste trenger uker eller måneder med rehabilitering for å gjenvinne sitt vanlige funksjonsnivå, og hos pasienter med de mest alvorlige tilfellene blir muskelsvakheten permanent. På lengre sikt er ICUAW assosiert med redusert livskvalitet, redusert kognitiv funksjon, vansker med å komme tilbake til arbeidslivet og økt 1 års mortalitet (4).
Intensivsykepleieren har et spesielt ansvar for å iverksette tiltak for å forebygge komplikasjoner som ICUAW, samt å iverksette tiltak for å bevare pasientens styrke og fysiske funksjon (5). ICUAW er derimot utfordrende å forebygge ettersom det er en klar sammenheng mellom alvorlighetsgraden av sykdom og utvikling av tilstanden. For eksempel har pasienter med sepsis, akutt lungesviktsyndrom (acute respiratory distress syndrome (ARDS)) og multiorgansvikt svært høy risiko for å utvikle ICUAW (6). Ifølge flere reviewer og primærstudier er det nærliggende å anta at adekvat ernæring har forebyggende effekt på ICUAW (7–11). Ernæring er avgjørende for å begrense muskelsvinn, og det er kjent at langvarig underernæring eller sult fører til negativt utfall for pasienten, som økt risiko for systemisk infeksjon, forverring av sykdomsalvorlighetsgrad og økt mortalitet (12,13). Ernæringens beskyttende effekt på muskelfunksjon er derimot ikke like påviselig hos intensivpasienter som hos andre pasientgrupper (7).
Flere studier har undersøkt sammenhengen mellom ulike ernæringsintervensjoner og ICUAW, men resultatene fra studiene spriker. Både American Society for Parenteral and Enteral Nutrition (ASPEN) (13) og European Society for Parenteral and Enteral Nutrition (ESPEN) (12) anbefaler økt protein- eller aminosyretilskudd til intensivpasienter på tross av at dette er basert på studier med lav kvalitet. Puthucheary et al. (6) fant derimot i sin studie at økt proteintilførsel var assosiert med økt risiko for å utvikle ICUAW. Dette funnet har blitt bekreftet av en annen studie som undersøkte sammenhengen mellom kalori- og proteindose og fysisk funksjon hos 389 intensivpasienter (14). I sistnevnte studie hadde pasientene med mest redusert funksjon etter intensivbehandling fått mer proteiner og kalorier ved tredje og syvende intensivdøgn sammenlignet med pasientene som ble skrevet ut med bedre fysisk funksjon. Funnene gjaldt både enteral ernæring (EE) og parenteral ernæring (PE). På den andre siden fant studien til Fetterplace et al. (15) en klar korrelasjon mellom graden av energiunderskudd og utvikling av ICUAW.
De motstridende resultatene fra studier kan delvis forklares av at både for lite, for mye eller for tidlig ernæring kan bidra til muskelsvakhet og nevropati (16,17). De første døgnene etter sepsis eller multiorgansvikt har pasienten en nevroendokrin stressrespons som reduserer metabolismen av tilført næring (18). Næringen blir da en belastning som hemmer en cellerensensende mekanisme som er avgjørende for at muskelstruktur vedlikeholdes. Tidlig fullernæring blir derfor en risikofaktor for utvikling av ICUAW (19).
Intensivpasientens ernæringsbehov er komplisert og avhenger av et tverrfaglig samarbeid mellom lege, ernæringsfysiolog og intensivsykepleier (20). Det er en legeoppgave å forordne EE og PE, mens intensivsykepleieren iverksetter ernæringstiltak og følger opp med relevante observasjoner. Om pasientens ernæringsbehov blir dekket, er derfor blant annet avhengig av intensivsykepleierens kunnskapsgrunnlag (20).
Når oppstart av ernæring til intensivpasienter bør igangsettes, og med hvilken komposisjon og mengde, er fremdeles uklart ettersom kliniske studier får motstridende resultater når de undersøker ICAUW (1,7). Det er ikke funnet systematiske litteraturstudier som er publisert eller registrert i PROSPERO som undersøker ernæringstiltak som gis under intensivoppholdet og har ICUAW som endepunkt. De systematiske litteraturstudiene som hittil er publisert har enten svært avgrensede endepunkt, som muskelvolum (8) eller sarkopeni (21), eller har tatt for seg avgrensede intervensjoner som PE (22,23) eller proteindosering (24,25). Hensikten med denne systematiske litteraturstudien var derfor å undersøke sammenhengen mellom ernæringen pasienten får under intensivoppholdet og utvikling av ICUAW på grunnlag av de primærstudiene som eksisterer på dette området. Studiens problemstilling var «Hvilken betydning har ernæring for utvikling av ICUAW?».
Metode
Denne studien er gjennomført som en systematisk litteraturstudie etter rammeverket til Booth, Sutton og Papaioannou (26). Dette designet er egnet ettersom hensikten er å sammenstille og kritisk vurdere all evidens som egner seg, ut fra bestemte seleksjonskriterier, til å besvare et spesifikt forskningsspørsmål (27). Denne systematiske litteraturstudien fulgte retningslinjene til PRISMA statement (28). Det er ikke publisert eller registrert en protokoll til denne studien.
Datainnsamling
Et systematisk litteratursøk i databasene Cinahl, Medline og Embase ble utført i november 2020. Nye treff i søket (alerts) fra alle tre databasene ble gjennomgått frem til mai 2021. Utforming av PICO-skjema og søkestrategi ble utarbeidet av førsteforfatter med hjelp fra spesialbibliotekar. Blant søkeordene som ble benyttet var: critical care, intensive care units, critical illness, critical care nursing, ICU, nutrition therapy, parenteral nutrition, enteral nutrition, nutritional support, nutrients, polyneuropathies, neuromuscular diseases, muscle weakness, muscular diseases, physical functional performance, muscular atrophy. Emneord og tekstord ble tilpasset de ulike databasene. PICO-skjema og fullstendig søkestrategi er beskrevet i vedlegg 1 og vedlegg 2. Det ble ikke gjort noen avgrensninger på årstall ettersom ernæringsintervensjoner i intensivforløpet med riktige utfallsmål vil være relevante uavhengig av hvilket år studien ble utført. Språk ble avgrenset til engelsk, norsk, svensk og dansk. På grunn av svært mange irrelevante treff i Embase ble det gjort flere avgrensninger i søket i denne databasen slik at «conference abstract», «conference paper», «conference review», «editorial», «letter» og «note» ble filtrert ut. Disse publikasjonstypene ble fjernet manuelt i Cinahl og Medline. I tillegg til litteratursøket ble det gjort håndsøk i de inkluderte artiklenes referanselister for å identifisere eventuelle studier som kan ha blitt utelatt fra søket.
Inklusjonskriterier og eksklusjonskriterier
Inklusjonskriterier omfattet RCT-studier på voksne intensivpasienter, hvor intervensjonen var ernæringstiltak som ble gitt på intensivavdeling. Studier som inkluderte pasienter ned til 16 år ble også inkludert. Inklusjonskriterier for utfallsmål var muskelsvinn eller fysisk funksjon relatert til intensivoppholdet. Studier ble ekskludert hvis de kombinerte ernæringstiltak med andre intervensjoner, eller hvis pasientenes nevropati eller muskelsvakhet hadde andre årsaker enn intensivbehandling. Pilotstudier og feasibilitystudier ble ekskludert hvis de manglet beregning av nødvendig utvalgsstørrelse for å finne effekt av et primærutfall. Tabell over inklusjon- og eksklusjonskriterier er vedlagt (vedlegg 3).
Seleksjonsprosess
Treffene fra søket ble overført til det digitale verktøyet Rayyan (29) for å holde orden i referansene og for blinding under seleksjonsprosessen. To forfattere (ÅØS og SAS, ÅØS og KH) vurderte individuelt artikler for inklusjon på bakgrunn av om tittel, sammendrag eller fulltekst møtte inklusjons- eller eksklusjonskriteriene. Artikler ble lest i fulltekst når det var uklart om de skulle inkluderes på bakgrunn av sammendraget. Ved tvil om en artikkel skulle inkluderes eller ekskluderes, ble en tredje forfatter konsultert.
Dataekstraksjon
Relevante data ble fylt inn i et dataekstraksjonsskjema basert på Fleeman og Dundars (30) oppskrift på dataekstraksjon og tabulering. Skjemaet ble først pilottestet på tre studier. Informasjon om studienes forfatter, årstall og land, studiens hensikt, populasjon og antall deltakere, ernæringsintervensjon og kontrollintervensjon, metode for mål av ICUAW og resultater som omfattet ICUAW ble fylt inn i dataekstraksjonsskjemaet. Dataekstraksjon fra de inkluderte studiene ble utført av førsteforfatter, mens en annen forfatter kontrollerte dataekstraksjonsskjema opp mot artiklene.
Analyse av data
På grunn av heterogenitet i studienes intervensjon og utfallsmål var det ikke mulig å gjøre en metaanalyse. Resultatene ble fremstilt i et narrativt format sammen med en tabell som beskrev studienes karakteristikk og funn (tabell 1). Funnene ble kategorisert etter endepunktene den systematiske litteraturstudien har som hensikt å undersøke. Resultatene ble derfor presentert etter utfallsmålene i studiene som omfattes av ICUAW.
Kvalitetsvurdering av inkluderte studier
Crititcal Appraisal Skills Programme (CASP) Checklist (31) ble brukt til å vurdere primærstudienes kvalitet. Kriteriene for kvalitetsvurderingen er presentert i tabell 2. Tabellen er utformet av førsteforfatter og basert på CASPs sjekkliste for randomiserte kontrollerte studier og inspirert av tabellen Ghouri (32) har brukt i sin systematiske litteraturstudie.
Resultater
Litteratursøket i Cinahl, Medline og Embase ga til sammen 5211 treff. Etter duplikater ble fjernet gjensto 4565 resultater. Av disse ble 4494 ekskludert på bakgrunn av inklusjons- og eksklusjonskriteriene etter å ha lest tittel eller sammendrag. En referanse var det ikke mulig å finne sammendrag til eller i fulltekst, og kunne derfor ikke vurderes (33). Sytti artikler ble lest i fulltekst og 55 av disse ble ekskludert. Oppdateringer fra nye treff fra søket i databasene ga to artikler som oppfylte studiens inklusjonskriterier. Ytterligere tre studier ble identifisert i de inkluderte studienes referanselister. Dette ga til sammen 20 inkluderte artikler (figur 1). De inkluderte artiklenes karakteristikk og resultater er sammenfattet i tabell 1.
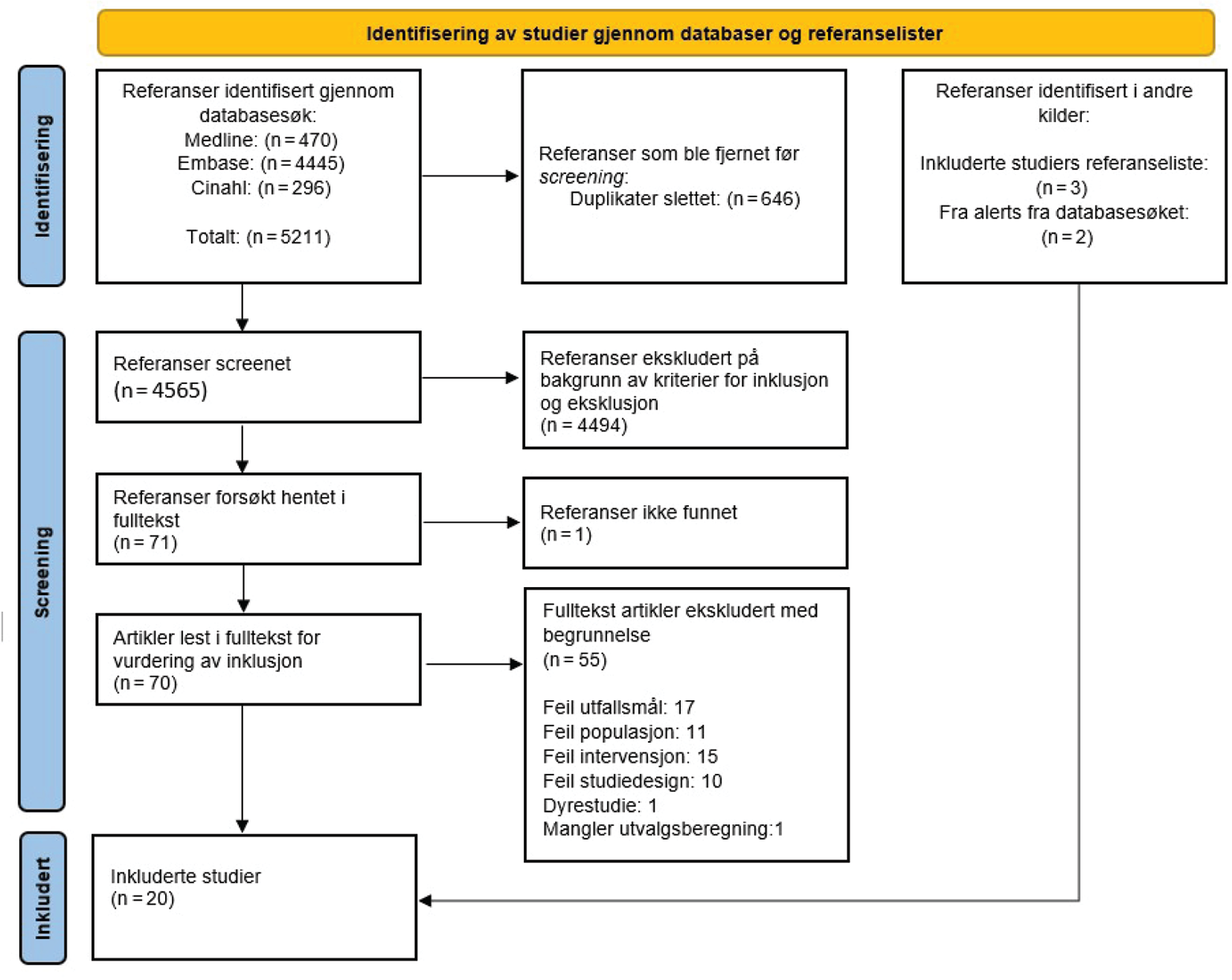
De 20 inkluderte artiklene er fordelt på 16 studier. Fire artikler er fra samme multisenter RCT-studie (34–37). To av disse har benyttet det samme datamaterialet, og bør derfor betraktes som samme studie i denne systematiske litteraturstudien (35,36). To artikler er oppfølgingsstudier av den samme multisenter RCT-studien (38,39) (tabell 1).
Studiene ble gjennomført i Australia (n = 4) (40–43), Australia og New Zealand (n = 3) (44–46), Japan (n = 1) (47), Belgia (n = 4) (34–37), Sveits (n = 1) (48), England (n = 1) (49), Tyskland (n = 1) (50), Danmark (n = 1) (51), Filippinene (n = 1) (52), USA (n = 2) (38,39) og Canada, Frankrike, USA og Belgia (n = 1) (53). Antall deltakere i studiene varierte mellom 15 og 2492 voksne intensivpasienter med respiratorbehandling. Sammenlagt inkluderte denne systematiske litteraturstudien 8604 pasienter. Åtte av studiene var multisenter RCT (34–36,38,39,42,44,45), syv var singlesenter RCT (37,40,47–51), tre var singlesenter pilot RCT (41,46,52) og to var multisenter pilot RCT (43,53).
I ni studier var intervensjonen PE (34–37,40,44,46,48,53). Av disse undersøkte syv effekten av tidlig PE eller tidlig supplerende PE (34–37,44,46,53). Åtte studier undersøkte effekten av enteral ernæring (EE) (38,39,41–43,47,49,52). Fem av de inkluderte studiene undersøkte effekten til økt protein- eller aminosyretilførsel (40,41,45,50,52), seks undersøkte effekten av økt kaloridose (38,39,41–43,48). En studie har undersøkt effekten av tilskudd av hydroksymetylbutyrat, en metabolitt av en aminosyre, som har som egenskap å oppregulere muskelproteinsyntesen (47). En studie undersøkte effekten av individualisert energi- og proteindosering målt ved indirekte kalorimetri og nitrogenbalanse (51). Ernæringen som ble gitt kontrollgruppen i studiene er beskrevet i tabell 1. Alle studiene hadde endepunkt som favnes av ICUAW-begrepet, selv om utfallsmålene var ulike. Tabell 3 oppsummerer utfallsmålene som ble brukt i primærstudiene for å undersøke effekten av intervensjonene på ICUAW.
Fysiske tester
Ni artikler undersøkte effekten av ernæringstiltak på pasientenes fysiske funksjon ved hjelp av fysiske tester (34–36,38,40,41,46,47,53). I fire av disse var fysisk funksjon studienes primærutfall (35,36,38,40). EPaNIC-studien (34–37) undersøkte effekten av å gi supplementell PE tidlig sammenlignet med å utsette PE til den åttende dagen i intensivforløpet. Substudier av EPaNIC fant at tidlig PE førte til signifikant høyere risiko for å få ICUAW målt med MRC-SS sammenlignet med sen PE (35,36). Samtidig fant en annen av EPaNIC-studiene ingen forskjell mellom gruppene ved mål av seks minutters gangtest og ADL ved utskrivelse fra sykehuset (34). Sistnevnte studie fant derimot at deltakerne som fikk sen PE, ble skrevet ut fra intensivavdeling og sykehus tidligere (34).
En studie (40) fant at PE med høyere aminosyrekonsentrasjon hadde signifikant positiv effekt på håndgrepsstyrke sammenlignet med standard PE. De seks andre inkluderte studiene som undersøkte håndgrepsstyrke eller andre fysiske tester fant ingen effekt av ernæringsintervensjonen sammenlignet med ernæringen som ble gitt til kontrollgruppen (38,41,46,47,49,53) (tabell 1).
Mål av muskler
Fem studier anvendte ultralyd til å måle ernæringsintervensjoners effekt på muskelmasse (40,41,48–50), og dette var primærutfall i to av studiene (49,50). To studier fant at ernæringsintervensjonen hadde beskyttende effekt på muskelvolum. I den ene av disse var ernæringsintervensjonen økt dose aminosyrer (40) og i den andre var intervensjonen volumstyrt EE sammenlignet med kontrollgruppen som fikk standard ernæringsbehandling (41). Endepunktet ble målt dag syv (40) og ved utskrivelse fra intensiv (41). De tre øvrige studiene fant ikke at ernæringsintervensjonen hadde signifikant effekt på muskelvolum målt med ultralyd (48–50) (tabell 1).
| Studie/årstall/land | Design | Hensikt | Populasjon | Intervensjon | Kontroll | Målemetode | Resultater |
|---|---|---|---|---|---|---|---|
|
Allingstrup et al. 2017 Danmark |
RCT |
Å vurdere effekten individualisert energi- og proteinberegning målt med indirekte kalorimetri og nitrogenbalanse har på fysisk livskvalitet målt etter 6 md. sammenlignet med standard behandling |
N = 199 Inklusjon: > 18 år, akuttinnleggelse på intensiv, respiratorbehandling, forventes å ligge på intensiv > 3 døgn, CVK, kunne lese og forstå dansk Eksklusjon: undervektige BMI ≤ 17 |
Individualisert kaloriberegning fra kalorimetri og ureaekskresjon i urin 1,5 g protein kg/døgn EE* + SPE* ble startet innen 24 t etter randomisering N = 88 |
Standard behandling: EE. 25 kcal/kg/døgn Oppstart innen 24 t etter randomisering, SPE etter tidligst 7 dager hvis EE er utilstrekkelig Følger ESPEN guidelines N = 88 |
SF-36* Målt etter 6 md. |
Ikke forskjell (p = 0,99) i SF-36 fysisk funksjon sammenlagt mellom gruppene |
|
Berger et al., 2019 Sveits |
RCT |
Å undersøke om intensivpasienter som ikke har oppnådd kcal-behovet sitt dag 3 etter ICU-innleggelse får bedre utfall i form av immunforsvar, inflammasjon og muskelsvinn ved tilskudd av PE* |
N = 23 Inklusjonskriterier: respiratorbehandling, fungerende mage- og tarmfunksjon, fått < 60 % av estimert kaloribehov innen dag 3 på intensiv. Forventet behov for intensivbehandling > 5 døgn Eksklusjonskriterier: alvorlig hjerneskade, hjertestans |
EE + SPE N = 11 |
EE N = 12 |
Ultralyd av låret (CSA)
|
Ikke signifikant forskjell (p = 0,068) i tap av muskelmasse mellom gruppene |
|
Casaer et al. 2011 Belgia |
Multi-senter RCT EPANIC* |
Å undersøke om å forebygge av kaloriunderskudd ved supplementell PE tidlig i sykdomsforløpet reduserer komplikasjons-raten, eller om å holde tilbake PE 1 uke er klinisk bedre |
N = 2056 Inklusjonskriterier: voksne intensivpasienter som er i risiko for underernæring, men har BMI > 17,
Eksklusjonskriterier: hjemmerespirator, eget ernæringsregime, døende, ikke CVK, re-innlagt på intensiv
|
Sen PE: PE tidligst dag 8 på intensiv N = 1060 Activities of daily living (ADL)
Uavhengig av randomisering ble EE startet dag 2 hvis matinntaket var utilstrekkelig per os |
Tidlig PE: oppstart innen 48 t N = 996 ADL N = 603 seks minutters gangtest |
Seks minutters gangtest ADL Målt ved utskrivelse fra sykehus |
Ikke signifikant forskjell (p = 0,57) i seks minutters gangtest mellom gruppene Ikke signifikant forskjell (p = 0,31) i ADL mellom gruppene |
|
Casaer et al. 2013 Belgia |
RCT Sub-studie av EPANIC |
Å vurdere hvilken effekt tidlig PE har på muskelvolum og muskelkomposisjon målt ved CT |
N = 15 Deltakere fra EPANIC-studien som har trengt hyppige CT-undersøkelser
Inklusjonskriterier:
Eksklusjonskriterier:
|
Sen PN: PE tidligst dag 8 på intensiv N = 5 |
Tidlig PE: oppstart innen 48 t N = 10 |
CT
|
Ingen signifikant forskjell (p = 0,6) i tap av femoralt muskelvolum mellom de to gruppene Ikke signifikant abdominalt muskelsvinn i noen av gruppene:
Fett-og væskeinnhold i muskelen økte med 25 % hos pasientene som fikk tidlig PE (p = 0,02). Dette skjedde ikke hos pasientene som fikk sen PE |
|
Deane et al. 2020 Australia |
Multi-senter RCT |
Å undersøke om oppnåelse av omtrent 100 % av anbefalt kaloriinntak hos intensivpasienter forbedrer mortalitet og langtids-komplikasjoner |
N = 2492 inklusjonskriterier: > 18 år, respiratorbehandling, forventet behov for EE > 1 døgn Eksklusjonskriterier:
|
1,5 kcal/ml EE N = 1222 |
1,0 kcal/ml EE N = 1270 |
EuroQol-5D-5L*
|
Ikke forskjell mellom gruppene i noen av kategoriene til EuroQol-5D-5L:
|
|
Doig et al. 2013 Australia og New Zealand |
Multi-senter RCT |
Å finne ut om tidlig PE til intensivpasienter som har kontra-indikasjoner til EE endrer pasientutfall |
N = 1372 Inklusjonskriterier:
Eksklusjonskriterier:
|
Tidlig PE, innen 24 timer etter innleggelse på intensiv N = 686 Oppstart tidlig PE: gjennomsnittlig etter 44 min etter inkludering i studien |
Standard behandling ikke definert N = 686: – 199 fikk initialt EE,
Oppstart ernæring: Gjennomsnittlig etter 2,8 døgn |
SGA*
Rand-36 general health status
Rand-36 physical function målt etter 60 dager ECOG* performance status målt etter 60 dager |
Signifikant mindre muskeltap i intervensjonsgruppen målt med SGA (p = 0,01) Intervensjonsgruppen skåret høyere på Rand-36 general health status sammenlignet med kontrollgruppen (p = 0,01) Ikke signifikant forskjell (p = 0,33) på Rand-36 physical function mellom gruppene Ikke signifikant forskjell (p = 0,70) i ECOG performance status mellom gruppene |
|
Doig et al. 2015 Australia og New Zealand |
Multi-senter RCT |
Å undersøke effekten på nyrefunksjonen ved korttids-behandling med daglig supplement med aminosyrer iv sammenlignet med standard behandling hos intensivpasienter |
N = 474 Inklusjon: forventet å ligge på intensiv > 2 dager, CVK Eksklusjon: væskerestriksjon <1 l/dag |
Supplement med 100 g/l aminosyrer dosert slik at pasienten oppnår en proteindose på 2 g/kg/dag i tillegg til standard behandling Intervensjonen varte til utskrivelse fra intensivavdelingen |
Ikke definert. Pasientens lege forordnet ernæringsmål og rute |
Rand-36 general health status Rand-36 physical function ECOG performance status Målt etter 90 dager |
Ikke signifikant forskjell (p = 0,41) i Rand-36 general health mellom gruppen Ikke signifikant forskjell (p = 0,11) på RAND-36 physical function mellom gruppene Ikke signifikant forskjell på ECOG performance status (p = 0,21) mellom gruppene |
|
Dresen et al. 2021 Tyskland |
RCT |
Å undersøke om en økning av proteininntak på 50 % i slutten av intensivforløpet kan opprettholde eller øke muskelmassen hos pasienter med langvarig intensivforløp |
N = 42 Inklusjonskriterier: alder 18-90 år, respiratorbehandling eller NIV, forbi den tidlige fasen med hemodynamisk ustabilitet ifølge ESPEN (nedadgående infeksjonsparametre, redusert behov for væskeresucitering og katekolaminer iv.), forventet behov for organstøtte > 28 dager Eksklusjonskriterier: ARDS, FiO2 > 0,6, ECMO, hodeskader, terminal kronisk nyresvikt |
1,8 g protein/kg/døgn N = 21 Ernæring ble gitt som EE, PE eller EE og PE i kombinasjon Deltakerne ble inkludert dag 13 ±2 etter innleggelse på intensiv |
1,2 g protein/kg/døgn N = 21 Ernæring ble gitt som EE, PE eller EE og PE i kombinasjon Deltakerne ble inkludert dag 13 ± 2 etter innleggelse på intensiv |
Ultralyd av quadriceps muscle layer thickness (QMLT) Målt ved begynnelsen av studie-perioden, etter 2 og 4 uker |
Ikke signifikant forskjell (p = 0,368) mellom gruppene på gjennomsnitts daglig QMLT-tap |
|
Ferrie et al. 2016 Australia |
RCT |
Å sammenligne standard aminosyreinntak med høyere dose aminosyrer til intensivpasienter |
N = 119 Inklusjonskriterier: > 16 år, behov for PE, forventet PE-behov >3 døgn Eksklusjonskriterier: Fått >1l/ >30 % av sitt energibehov som PE eller EE de siste tre døgnene |
PE med høyere innhold av aminosyrer (1,2 g/kg/døgn) N = 59 |
Standard PE (0,8 g/kg/døgn) N = 60 |
Håndgrepsstyrke dag 7 og ved utskrivelse fra intensiv Ultralyd
|
Signifikant bedre håndgrepsstyrke ved dag 7 i intervensjonsgruppen sammenlignet med kontrollgruppen (p = 0,025) Ved utskrivelse fra intensiv var forskjellen ikke lenger signifikant (p = 0,054) Ultralyd: Signifikant mindre muskelsvinn i intervensjonsgruppen enn kontrollgruppen (p = 0,02). |
|
Fetterplace et al. 2018 Australia |
Pilot RCT |
Å undersøke om volum-styrt protokoll med tilsatt protein fører til økt protein- og energitilførsel til pasientene sammenlignet med standard behandling |
N = 60 Inklusjonskriterier: >18 år, respiratorbehandling >48 t ved inklusjon, forventet respiratorbehov >72 t Eksklusjonskriterier: kontraindikasjon til EE, ikke forventet overlevelse, gravide, ikke i stand til å bevege seg > 10 m, behandlende lege mener ernærings-intervensjonen er kontraindisert |
Volumbasert ernæringsprotokoll basert på at pasientene skulle få 25 kcal/kg/døgn Konsentrert EE med 1250 kcal/L og 63 g/L protein N = 30 |
Standard behandling 1,0 kcal/ml = 1000 kcal/l og 40 g protein N = 30 |
Ultralyd av lårmuskulatur, QMLT målt ved utskrivelse fra intensiv ev. studiedag 15 hvis intensiv-oppholdet varte lengre MRC-SS* Målt etter oppvåkning eller når pas. er samarbeidende + ved utskrivelse / studiedag 15 Håndgrepsstyrke Målt samtidig med MRC-SS PFIT-s* Målt samtidig med MRC-SS |
Intervensjonsgruppen hadde mindre muskelsvinn målt med ultralyd sammenlignet med kontrollgruppen (p = 0,01) Ikke signigikant forskjell (p = 0,53) på MRC-SS mellom gruppene Ikke signifikant forskjell (p = 0,94) i håndgrepsstyrke mellom gruppene Ikke signifikant forskjell (p = 0,49) i PFIT-s mellom gruppene |
|
Hermans et al. 2013 Belgia |
Multi-senter RCT Sub-analyse av EPANIC |
Å vurdere om sen PE og tidlig PE hadde forskjellig effekt på utvikling av muskelsvakhet og autofagisk kontroll av muskelfibre |
N = 600 Inklusjonskriterier: voksne intensivpasienter som er i risiko for underernæring, men har BMI > 17, NRS ≥3 (1-7) Eksklusjonskriterier: hjemmerespirator, eget ernæringsregime, døende, ikke CVK, re-innlagt på intensiv Spiser per os Eksklusjonskriterier for MRC-SS-vurdering: Aldri våknet, neuromuskulær sykdom, fremdeles medisinsk ustabile Eksklusjonskriterier for muskelbiopsi: koagulasjonssvikt |
Sen PE: PE tidligst dag 8 på intensiv N = 305 Muskelbiopsi: N = 61 Uavhengig av randomisering ble EE startet dag 2 hvis matinntaket var utilstrekkelig per os |
Tidlig PE: Oppstart innen 48 t N = 295 Muskelbiopsi: N = 61 |
MRC-SS* målt dag 8 eller senere når pasienten er våken og samarbeidende (median døgn 9). Deretter X 3 per uke til utskrivelse fra intensiv eller død Muskelbiopsi 8 dager etter randomisering |
Flere i tidlig PE-gruppen utviklet muskelsvakhet sammenlignet med de som fikk sen PE (p = 0,03) Ikke signifikant forskjell (p = 0,15) mellom gruppene ved siste MRC-ss måling Ikke signifikant forskjell (p = 0,19) i muskelfibertetthet mellom intervensjons- og kontrollgruppen. |
|
McNelly et al. 2020 England |
RCT |
Å undersøke om intermitterende enteral ernæring fører til mindre muskeltap sammenlignet med kontinuerlig enteral ernæring |
N = 121 Inklusjon: >18 år Forventes intubert ≥ 48 timer, forventes å overleve ≥ 10 dager, behov for EE > 2 i SOFA score i ≥ domener ved innleggelse Eksklusjon: Fått EE på sengepost eller på intensivavdeling > 12 timer, ikke forventet å oppnå ernæringsmål innen 72 timer med EE alene |
Intermitterende enteral ernæring
Sondematen ble gitt over 3–5 min. Compact ernæringsformel. Individuelt ernæringsmål satt innen 72 timer N = 62 Inkludert i ultralydanalyse til dag
|
Kontinuerlig enteral ernæring totalvolum gis over 24 t, etter lokal ernæringsprotokoll N = 59 Inkludert i ultralydanalyse til dag 10 N = 31 |
Ultralyd
Sit-to stand-test ved utskrivelse fra intensiv Bed-to-chair-transfer ved utskrivelse fra intensiv |
Ikke signifikant forskjell (p = 0,676) mellom gruppene i muskelsvinn målt ved ultralyd dag 10 Ikke signifikant forskjell (p = 0,324) i sit-to-stand time mellom gruppene Ikke forskjell (p = 0,868) i first bed to chair transfer mellom gruppene |
|
Nakamura et al. 2020 Japan |
RCT |
Å undersøke om tilførsel av hydroksymetylbutyrat (HMB) forebygger tap av muskelvolum hos alvorlig syke intensivpasienter i tidlig akuttfase |
N = 50 Inklusjonskriterier: ≥ 20 år, overlever > 2 døgn Eksklusjonskriterier: kontraindikasjon til EE, tidlig utskrivelse fra intensivavdeling, multiresistente bakterier, gravid, pacemaker, ECMO |
Standard behandling + fra studiedøgn 2 ble det administrert 3 g HMB, 14 g arginine, 14 g glutamine per døgn i nasogastrisk sonde Behandling med HMB ble kontinuert i 10 døgn N = 26 |
Standard behandling: EE innen 48 t Oppstart: 10 ml/t, trappes opp til 20–30 kcal/kg/døgn ved døgn 7 N = 24 |
CT femoral muskel målt dag 1 + dag 10 Barthel index ved utskrivelse |
Ikke signifikant forskjell (p = 0,18) i femoralt muskeltap mellom intervensjonsgruppen og kontrollgruppen Ikke signifikant forskjell (p = 0,65) i barthel index mellom gruppene |
|
Needham, Dinglas, Morris et al. 2013 USA |
Multi-senter RCT Oppfølgnings-studie EDEN |
Å vurdere fysisk og kognitiv funksjon 6 og 12 mnd etter akutt lungesykdom (ALI) og vurdere effekten av trofisk ernæring sammenlignet med enteral fullernæring gitt i løpet av de første seks dagene med respiratorbehandling |
N = 149 Inklusjonskriterier: > 18 år, akutt lungeskade (ALI) oppstått siste 48 timer, respirator-behandling < 72 timer ved inklusjon, behov for EE, ingen kognitive eller psykiske diagnoser fra tidligere Eksklusjonskriterier: kronisk lungesykdom, alvorlig leversvikt, alvorlig underernæring, PE, døende, intracereberal blødning |
Trofisk EE N = 75 |
Enteral fullernæring: N = 74 |
Seks minutters gangtest Fire minutters ganghastighet MRC-SS Håndgreps-styrke Armmuskel-volum målt med antropo-metrisk vurdering av overarm Målt etter 12 md. |
Ikke signifikant forskjell (p = 0,136) i seks minutters gangtest mellom gruppene Ikke signifikant forskjell (p = 0,125) i fire minutters ganghastighet mellom gruppene Ikke forskjell (p = 0,901) i MRC-SS mellom gruppene Ikke forskjell (p = 0,462) i håndgrepsstyrke mellom gruppene Ikke forskjell (p = 0,703) i armmuskelvolum mellom gruppene |
|
Needham, Dinglas, Bienvenu et al. 2013 USA |
Multi-senter RCT Oppfølgnings-studie EDEN |
Å vurdere effekten trofisk vs. fullernæring med EE har på fysisk funksjon og sekundærutfall hos pasienter med ALI |
N = 525 Inklusjonskriterier: > 18 år, ALI oppstått siste 48 timer, respirator-behandling < 72 timer ved inklusjon. Behov for EE, engelsktalende, ingen kognitive eller psykiske diagnoser fra tidligere
|
Trofisk EE N = 259 Etter 6 døgn fikk alle pasientene fullenæring uavhengig av randomisering |
Enteral fullernæring: N = 228 |
SF-36 EuroQol 5D-3L* Målt etter 12 md. |
Ikke signifikant forskjell (p = 0,54) i SF-36 fysisk funksjon sammenlagt Ikke forskjell (p = 0,75) i EuroQol 5D-3L utility score Flere i trofisk-gruppen hadde trengt rehabiliteringsopphold etter 6 md. |
|
Reid et al. 2016 Australia |
Oppfølgningsstudie av feasibility RCT |
Å undersøke hvilken effekt økt kaloriinntak ved EE med 1,5 kcal/ml sammenlignet med EE med 1,0 kcal/ml har på fysisk funksjon og mental helse et år etter kritisk sykdom Substudie fra Target pilotstudie |
N = 39 Inklusjon: > 18 år, Forventet behov for EE > 2 døgn Eksklusjonskriterier: Fått PE/EE >12 t ved inkludering, kontraindikasjoner til intervensjonen |
1,5 kcal/ml EE N = 23 Intervensjonen varte inntil de 10 første dagene på intensivavdeling Like mye proteiner pr/ml i begge gruppene |
1,0 kcal/ml EE N = 16 Like mye proteiner pr/ml i begge gruppene |
SF-36 EuroQol-5D-5L Målt etter 12 md. |
Ikke signigikant forskjell (p = 0,9) i SF-36 fysisk funksjon mellom gruppene Ikke signifikant forskjell mellom gruppene på noen av kategoriene til EuroQol-5D-5L:
|
|
Ridley et al. 2018 Australia og New Zealand |
Pilot RCT |
Å undersøke om PE som supplement til EN med oppstart 48–72 timer etter intensivinnleggelse i inntil 7 dager fører til økt energitilskudd sammenlignet med standard behandling med EE |
N = 99 Inklusjonskriterier: > 16 år, respiratorbehandling, minst enorgansvikt, har fått < 80 % av estimert kaloribehov, CVK Eksklusjonskriterier: kontraindikasjon til EE/PE, fikk PE ved randomisering, ikke forventet overlevelse |
EE + SPE opptil syv dager etter randomisering for å oppnå 100 % av estimert kaloribehov.
N = 51 |
EN, evt. EN+PN hvis EN var utilstrekkelig N = 48 |
EuroQol 5D-3L Håndgrepsstyrke ICU-mobility scale Overarmsomkrets Målt ved utskrivelse fra sykehus |
Ikke signifikant forskjell mellom gruppene i EuroQol 5D-3L
Ikke signifikant forskjell (p = 0,71) i håndgreps-styrke mellom gruppene Ikke signifikant forskjell (p = 0,58) i ICU mobility scale mellom gruppene Ikke sigifikant forskjell (p = 0,91) i overarmsomkrets mellom gruppene |
|
Van Dyck et al. 2019 Belgia |
Multi-senter RCT Sub-analyse av EPANIC |
Å undersøke om sen PE påvirker vekst-hormon-aksen (growth hormone axis) i forhold til kliniske utfallsmål |
N = 600 Inklusjonskriterier: voksne intensivpasienter som er i risiko for underernæring, men har BMI > 17, NRS ≥ 3 (1–7) Eksklusjonskriterier: hjemmerespirator, eget ernæringsregime, døende, ikke CVK, re-innlagt på intensiv, spiser per os |
Sen PE: PE tidligst dag 8 på intensiv N = 305 Uavhengig av randomisering ble EE startet dag 2 hvis matinntaket var utilstrekkelig per os |
Tidlig PE: Oppstart innen 48 t N = 295 |
MRC-SS
|
Flere i tidlig PE-gruppen utviklet muskelsvakhet sammenlignet med de som fikk sen PE (p = 0,03) |
|
Vega-Alava et al. 2018 Filipinene |
Pilot RCT |
Å undersøke effekten proteintilskudd gitt sent i intensivforløpet har på respirator-avvenningstiden |
N = 40 Inklusjonskriterier: innleggelsesårsak er respirasjonssvikt, respiratorbehandling, behov for EE, SAPS < 39,5 Eksklusjonskriterier: nevrologiske lidelser, GFR ≤ 60, uregulert diabetes, leversvikt |
Proteinpulver EE tilsvarende 18 g proteiner per pasient/dag, som tilskudd til standard EE N = 20 |
Standard EE N = 20 |
Overarm Somkrets |
Pasientene i intervensjonsgruppen hadde signifikant (p = 0,00) større overarmsomkrets sammenlignet med kontrollgruppen |
|
Wischmeyer et al. 2017 USA
|
Multi-senter pilot RCT |
Å undersøke om PE som supplementær behandling til EE kan øke ernæringstilførselen med 30 %, og om dette øker 60-dagers overlevelse og livskvalitet hos undervektige og hos overvektige sammenlignet med EE alene |
N = 125 Inklusjonskriterier: > 18 år, akutt respirasjonssvikt, forventet respiratortid > 72 t, BMI < 25 eller > 35, kan få EE innen 48 t Eksklusjonskriterier: > 72 t fra intensivinnleggelse til samtykke, ikke forventet overlevelse > 48 t fra screening, kontraindikasjon til EE, allerede ernært med EE/PE, fulminant leversvikt, ikke forventet overlevelse |
EE + PE N = 52 PE: samme lignende kaloritetthet som EE (1,2 kcal/ml). Justert daglig slik at kalorimålet til pasienten ble nådd |
Kun EE N = 73 EE: 1,2 ± 0,2 kcal/ml. Oppstart 20 ml/t med økning hver 4. time dersom tolerert frem til måldose |
Håndgrepsstyrke ved utskrivelse fra intensivavdeling og fra sykehus Seks minutters gangtest ved utskrivelse fra sykehus Barthel Index ved utskrivelse fra sykehus SF-36 etter 3 og 6 md. |
Ikke signifikant forskjell mellom gruppene i håndgrepsstyrke i intervensjonsgruppen ved utskrivelse fra intensivavdeling (p = 0,21) og fra sykehus (p = 0,14) Ikke signifikant forskjell (p = 0,2) i seks minutters gangtest mellom gruppene Ikke signifikant forskjell (p = 0,08) på Barthel Index Ikke signifikant forskjell i SF-36 fysisk funksjon sammenlagt etter 3 md. (p = 0,38) og etter 6 md. (p = 0,17) |
*Forkortelser: EE = enteral ernæring, SF-36 = short form 36, SPE = suplementell parenteral ernæring, PE = parenteral ernæring, EPANIC = The Early Parenteral Nutrition Completing Enteral Nutrition in Adult Critically Ill Patients, ADL = Activities of daily living, SGA = Subjective global assessment, ECOG = Eastern Collaborative Oncology Group, MRC-SS = Medical research council sum score, PFIT-s = Physical function in intensive care unit test, EuroQol-5D-5L = EuroQol five dimensions five-level questionnaire, EuroQol 5D-3L = EuroQol five dimensions three-level questionnaire
| Fysiske tester | Mål av muskler | Livskvalitet og selvrapportert fysisk funksjon |
|---|---|---|
|
– Håndgrepsstyrke – Barthel indeks – Medical research council sum score (MRC-SS) – Physical function in intensive care unit test (PFIT-s) – ICU-mobility scale – Seks minutters gangtest – Fire minutters ganghastighet – Activities of daily living (ADL) |
– Ultralyd – CT – Biopsi – Subjective Global Assessment (SGA) – Overarmsomkrets |
– RAND-36 – Short form 36 (SF-36) – EuroQol-5D-3D – EuroQol-5D-5L – ECOG performance status |
To studier målte muskelvolum med CT og fant ingen effekt (37,47). Den ene studien undersøkte også muskelkomposisjon, og fant at tidlig PE reduserte kvaliteten på muskelvevet i form av økt intramuskulært vann- og fettinnhold (37).
En studie målte muskelmasse ved SGA og fant at tidlig PE førte til signifikant mindre muskelsvinn sammenlignet med standard behandling (44).
Livskvalitet og fysisk funksjon
Åtte studier undersøkte ernæringsintervensjoners effekt på selvrapportert livskvalitet og fysisk funksjon to, tre, seks og tolv måneder etter intensivoppholdet (39,42–46,51,53). Spørreskjemaene RAND-36 (44,45), SF-36 (39,43,51,53), EuroQol-5D-3L (39,46) og EuroQol-5D-5L (42,43) ble benyttet i de ulike studiene. En studie (44) fant signifikant forskjell i generell helse målt med RAND-36 til fordel for intervensjonsgruppen som fikk tidlig PE. Utfallsmålet ble målt etter 2 måneder. De øvrige inkluderte studiene fant ingen forskjell mellom intervensjons- og kontrollgruppen etter utskrivelse fra sykehuset (39,42,43,45,46,51,53). Ernæringsintervensjonene som ble undersøkt i disse studiene er presentert i tabell 1.
Vurdering av risiko for systematiske skjevheter
En oversikt over kvalitetsvurdering av de enkelte studiene etter CASP sjekkliste for RCT-studier er presentert i tabell 2. I kvalitetsvurderingen er det tatt utgangspunkt i studienes primærutfall, og sammenlagt er kvaliteten på studiene vurdert til å være god. Endepunkt som var mål på ICUAW var derimot sekundærutfall i seks av de inkluderte studiene (34,41,44–46,53) og fem av studiene er pilotstudier (41,43,46,52,53). Som følge av dette er det ikke adekvat utvalg til å finne effekt i utfallmål på ICUAW i fem av de inkluderte studiene (41,43,46,52,53), men dette kommer ikke frem i oversikt over kvalitetsvurdering (tabell 2). Videre var tre av studiene dobbelblindet og 15 av studiene var blindet i analysen. I flertallet av studiene er det uklart om deltakerne fikk lik behandling på tvers av gruppene utenom intervensjonen. I 19 av de 20 inkluderte studiene var resultatene rapportert omfattende og forståelig.
|
Studie |
Er RCT egnet studiedesign? | Er studien metodologisk korrekt? | Hva var resultatene? | Er resultatene til hjelp i praksis? | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Er forsknings-spørsmålet tydelig?
Adekvat randomi-sering? Var alle deltakerne gjort rede for ved studiens analyse? |
Var pasienter blindet? | Var klinikere blindet? | Var forskerne som utførte analysen blindet? | Er intervensjons-gruppen og kontroll-gruppen like ved studiens oppstart? | Fikk intervensjons-gruppen og kontroll-gruppen lik behandling utenom intervensjonen? | Ble effekten av intervensjonen rapportert omfattende og fullstendig? | Er sprednings-mål for resultatet rapportert? | Veier fordelene av intervensjonen opp for ulempene? | Kan resultatene overføres til praksis? | Vil intervensjonen være til større nytte enn noen av de ekstisterende tiltakene? | |
| Allingstrup et al. 2017 | Ja | Nei | Nei | Ja | Ja | Ja | Ja | Ja | Nei | Ja | Nei |
| Berger et al. 2019 | Ja | Nei | Nei | Ja | Ja | Uklart | Ja | Ja | Ja | Ja | Nei |
| Casaer et al. 2011 | Ja | Nei | Nei | Ja | Ja | Uklart | Ja | Uklart | Ja | Ja | Ja |
| Casaer et al. 2013 | Ja | Nei | Nei | Ja | Nei | Ja | Ja | Ja | Ja | Nei | Nei |
| Deane et al. 2020 | Ja | Ja | Ja | Ja | Uklart | Uklart | Ja | Ja | Nei | Ja | Nei |
| Doig et al. 2013 | Ja | Nei | Nei | Ja | Ja | Uklart | Ja | Ja | Nei | Ja | Nei |
| Doig et al. 2015 | Ja | Nei | Nei | Nei | Nei | Uklart | Ja | Ja | Nei | Ja | Nei |
| Ferrie et al. 2016 | Ja | Ja | Ja | Ja | Ja | Uklart | Ja | Ja | Ja | Nei | Nei |
| Fetterplace et al. 2018 | Ja | Nei | Nei | Ja | Nei | Uklart | Ja | Ja | Ja | Nei | Nei |
| Hermans et al. 2013 | Ja | Nei | Nei | Ja | Ja | Ja | Ja | Ja | Ja | Ja | Ja |
| Mcnelly et al 2020 | Ja | Nei | Nei | Ja | Ja | Uklart | Ja | Ja | Ja | Ja | Nei |
| Nakamura et al. 2020 | Ja | Nei | Nei | Ja | Ja | Ja | Ja | Ja | Nei | Ja | Nei |
| Needham et al. 2013* | Ja | Nei | Nei | Ja | Ja | Ja | Ja | Ja | Nei | Ja | Uklart |
| Needham et al. 2013** | Ja | Nei | Nei | Ja | Nei | Ja | Ja | Ja | Nei | Ja | Uklart |
| Reid et al. 2016 | Ja | Ja | Ja | Ja | Ja | Uklart | Ja | Ja | Nei | Nei | Nei |
| Ridley et al. 2018 | Ja | Uklart | Nei | Uklart | Ja | Uklart | Ja | Ja | Ja | Nei | Nei |
| VanDyck et al. 2019 | Ja | Nei | Nei | Ja | Ja | Uklart | Ja | Ja | Ja | Ja | Uklart |
| Wischmeyer et al. 2017 | Ja | Nei | Nei | Uklart | Ja | Uklart | Ja | Ja | Ja | Nei | Nei |
| Vega-Alava et al. 2018 | Ja | Nei | Nei | Nei | Ja | Uklart | Nei | Nei | Uklart | Nei | Uklart |
*Needham, D. M., Dinglas, V. D., Bienvenu, O. J., Colantuoni, E., Wozniak, A. W., Rice, T. W., … Network, N. N. A. (2013). One year outcomes in patients with acute lung injury randomised to initial trophic or full enteral feeding: prospective follow-up of EDEN randomised trial. BMJ, 346, f1532. https://dx.doi.org/10.1136/bmj.f1532
**Needham, D. M., Dinglas, V. D., Morris, P. E., Jackson, J. C., Hough, C. L., Mendez-Tellez, P. A., … Hopkins, R. O. (2013). Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding EDEN Trial follow-up. American Journal of Respiratory and Critical Care Medicine, 188(5), 567-576. http://dx.doi.org/10.1164/rccm.201304-0651OC
Diskusjon
Hensikten med denne systematiske litteraturstudien var å besvare hvilken betydning ernæring har for utvikling av ICUAW. På tvers av studiene er det stor heterogenitet i intervensjoner, utfallsmål, utvalgsstørrelse og måletidspunkt. Dette gjør sammenstilling av resultatene utfordrende. Resultatene i de inkluderte studiene er motstridende, og det er for få studier av god kvalitet til å fastslå betydningen av ulike ernæringstiltak på ICUAW. I de studiene som fant effekt av ernæringstiltak viste det seg at effekten var raskt avtagende. Ingen av studiene som undersøkte pasientenes fysiske funksjon etter utskrivelse fant effekt av ernæringsintervensjonene.
På tvers av studiene er det ingen sammenheng mellom hvilke typer intervensjoner som hadde effekt og ikke. Studier av god kvalitet som undersøkte effekten av tidlig PE viste varierende resultater. Én studie fant at tidlig PE hadde forebyggende effekt på muskelsvinn (44), mens to andre studier fant at tidlig PE økte risikoen for muskelsvakhet (35,36). Det er likevel verdt å merke seg at studiene som målte pasientenes muskelstyrke (35,36) fant effekt av å utsette PE. Muskelstyrke er et mer klinisk relevant utfallsmål sammenlignet med muskelsvinn, som er et surrogatutfall (17). En av de inkluderte studiene viste også at økt mengde PE førte til økt intramuskulært vann- og fettinnhold målt med CT (37). Dette resultatet må derimot tolkes med forsiktighet. Studien har kun 15 deltakere ettersom CT-undersøkelsene bare ble tatt på klinisk indikasjon. Likevel indikerer studien at økt intramuskulært volum, uten økt muskelfiberstørrelse, er en mulig forklaring på at enkelte studier finner effekt av økt mengde ernæring på muskelvolum, men ikke på pasientenes muskelstyrke (41,44).
Det er for få studier av god kvalitet til å fastslå effekten av proteintilskudd på utvikling av ICUAW. Ferrie et al. (40) fant positiv effekt på muskelvolum målt ved ultralyd og muskelstyrke målt med håndgrepsstyrke hos pasientene som fikk større dose proteiner (40). Dresen et al. (50) fant derimot ikke effekt av økt proteindose målt med ultralyd. Begge studiene har adekvat utvalg, men intervensjonene er så ulike at studiene ikke er sammenlignbare. Ferrie et al. (40) sammenlignet effekten av 0,8 gram protein/kg/døgn med 1,2 gram protein/kg/døgn, mens Dresen et al. (50) sammenligner 1,2 gram protein/kg/døgn med 1,8 gram protein/kg/døgn. Sistnevnte studie undersøker også effekten av intervensjonen gitt sent i intensivoppholdet og har derfor ikke inkludert pasienter før intensivdøgn 13. I studien er det ikke oppgitt eller tatt høyde for ernæringen pasientene fikk de 13 første døgnene av intensivforløpet. Vega-Alava et al. (52) fant ved mål av overarmsomkrets at pasientene som fikk tilskudd av 18 g protein enteralt per døgn hadde mindre muskelsvinn sammenlignet med de som fikk standard EE. I studien oppgir de ingen kilder på hvordan overarmsomkrets korrelerer med muskelvolum. Studien har også inkludert 40 deltakere, samtidig som det oppgis at det trengs et utvalg på 183 pasienter.
Funnene er også motstridende blant studiene som undersøkte effekten av tiltak for å øke kalori- og proteintilførsel med EE. I studien til både Fetterplace et al. (41) og McNelly et al. (49) fikk intervensjonsgruppen mer av sitt estimerte protein- og kaloribehov sammenlignet med kontrollgruppen. Begge målte muskelsvinn med ultralyd, men intervensjonen ga kun redusert muskelsvinn i studien til Fetterplace et al. (41). Sistnevnte studie mangler derimot ultralydmål hos 23 prosent (n = 6) av deltakerne i intervensjonsgruppen og 27 prosent (n = 7) av deltakerne i kontrollgruppen. Gruppene i denne studien var heller ikke like ved oppstart.
I de fleste studiene som finner effekt av ernæringstiltak (35,36,40,44), er det gjennomgående at effekten er raskt avtagende. I tre av studiene (36,40,44) har forskjellene opphørt før utskrivelse fra intensivavdelingen. Tidspunktet endepunktet blir målt, ser ut til å være av betydning for om det viser seg å være effekt av intervensjonen, uavhengig av ernæringsintervensjon og valg av endepunkt (35,36,40,44). Dersom effekten av intervensjonen på ulike utfallsmål av ICUAW er svært kortvarig, vil den kliniske relevansen bli mindre ettersom ICUAW har stor betydning for rehabiliteringsforløpet til pasienten, og ofte innebærer langvarig redusert fysisk funksjon (9).
En av årsakene til at effekten av ernæringsintervensjonen er kortvarig, kan være at varigheten på ernæringsintervensjonene er kort. I åtte av de inkluderte studiene varte ernæringsintervensjonen mellom fem til ti dager, eller kortere for pasienter som ble skrevet ut fra intensivavdelingen tidligere (36,38,40,43,46,48,49,53). I andre av de inkluderte studiene, er intervensjonen designet slik at forskjellen mellom intervensjonsgruppen og kontrollgruppen utjevnes i løpet av intensivoppholdet. Dette er for eksempel tilfelle i Doig et al. (44) sin studie, der intervensjonsgruppen og kontrollgruppen fikk omtrent like mye kalorier og proteiner ved det syvende døgnet på intensivavdeling. De kortvarige intervensjonene er antakelig et resultat av at pasienten vil ha et annet ernæringsbehov etter omtrent fem til ti dager, når det antas at den fysiologiske stressresponsen til en viss grad har gått over.
Ingen av de ni inkluderte studiene i denne systematiske litteraturstudien som undersøkte pasientenes fysiske funksjon etter utskrivelse fant effekt av ernæringsintervensjonen (38,39,42–46,51,53). Riktignok fant en av studiene (44) en signifikant effekt i generell helse målt med Rand-36, men dette gjaldt ikke for fysisk funksjon, som er en av domenene til instrumentet. Videre var den påviste effekten av ernæringsintervensjonen så liten at den ikke var av klinisk betydning.
Resultatene fra de inkluderte primærstudiene i denne systematiske litteraturstudien tyder på at effekten av ernæringsintervensjoner som gis i intensivforløpet ikke er langvarig nok til å påvirke pasientenes fysiske funksjon tre, seks og tolv måneder senere. En eventuell effekt kan også ha blitt overskygget av de andre faktorene som påvirker en intensivpasients funksjonsnivå etter utskrivelse fra sykehus, eksempelvis mestringsevne, psykososiale forhold og rehabilitering, for å nevne noe (54–56). I den grad det er mulig bør studier som måler langtidseffekter, kartlegge slike faktorer for å unngå risiko for skjevheter i pasientutvalget som kan påvirke resultatet. Av de inkluderte studiene som undersøker ICUAW etter utskrivelse, har kun to (38,39) forsøkt å ta høyde for slike konfunderende faktorer. Needham et al. (38,39) har i sine studier inkludert faktorer som om pasientene var hjemmeboende og selvhjulpne, bodde på institusjon eller var i arbeid før innleggelse på intensiv. I tillegg har deltakerne i studien besvart SF-36 om hvordan livskvaliteten og funksjonsnivået var før innleggelse. Dette er informasjon om pasientutvalget som kan være viktig og som er oversett i de andre studiene. Hvis gruppene ikke er like i utgangspunktet, kan vi ikke vite om det var intervensjonen eller andre faktorer som var utslagsgivende for resultatet. Det er ikke mulig å kontrollere for alle variabler som kan påvirker endepunktet. Når det er langtidseffekter i form av fysisk funksjon som undersøkes, kan derimot faktorer som tidligere fysisk funksjon og sosiale forhold være av stor betydning for pasientutfallet (9).
Et bifunn i en av studiene til Needham et al. (39) var at flere i gruppen som fikk trofisk ernæring hadde hatt behov for rehabiliteringsopphold i ettertid av intensivoppholdet sammenlignet med kontrollgruppen som ble fullernært med EE. Med trofisk ernæring menes en liten dose EE, for eksempel 10 ml/t med hensikt å vedlikeholde tarmslimhinnen og tarmfloraen, men ikke å dekke pasientens energibehov (12). Studiene fant likevel ingen forskjell mellom gruppene i utfallsmålene som de hadde planlagt for (38,39). Andelen som var i arbeid (39), resultater ved seks minutters gangtest og pasientens styrke målt med MRC-SS (38), var lik i begge gruppene seks og tolv måneder etter utskrivelse.
Det er kanskje ikke sannsynlig at en kortvarig ernæringsintervensjon alene er en potent nok intervensjon til å påvirke funksjonsnivået til intensivpasienter seks og tolv måneder senere (17). Det blir derfor viktig å avklare hvor lenge intervensjonen skal ha effekt for at den skal være av klinisk betydning for pasienten. Det bør derfor utarbeides konsensus for hvilke utfallsmål som er best egnet til å måle ICUAW og på hvilket tidspunkt de skal måles, slik at studier kan sammenlignes (17,57).
Resultatene i denne systematiske litteraturstudien samsvarer med to systematiske litteraturstudier som er lignende, men som undersøker spesifikke ernæringsintervensjoner (24) og avgrensede utfallsmål (8), som nevnt innledningsvis. Disse reviewene viser at resultatene fra primærstudiene er motstridende, og at det er for lite evidens til å trekke konklusjoner på ernæringsintervensjonenes effekt på utfallsmål som kan kategoriseres som ICUAW. Andre systematiske litteraturstudier med metaanalyser som undersøker ernæringsintervensjoners effekt på andre utfallsmål, finner at ernæringsintervensjonen ikke har effekt (58,59). Systematiske litteraturstudier som undersøker ulike intervensjoners effekt på muskelmasse og fysisk funksjon, finner derimot at fysioterapi og treningsbaserte intervensjoner har forebyggende effekt på ICUAW (21,22).
Manglende effekt i RCT-studier kan være en konsekvens av at intensivpasienter kan ha ulik respons på samme ernæringsintervensjon. Bear et al. (60) peker på at intensivpasienters heterogenitet representerer en stor utfordring i ernæringsstudier fordi ulike pasienter har ulikt behov for ernæring. I primærstudiene er det som oftest sørget for at utvalgene er like i diagnose, sykdomsalvorlighetsgrad, kjønn, alder og BMI. Pasientene er derimot også forskjellige i kroppskomposisjon og ernæringsstatus før innleggelse. I tillegg har pasientene forskjellig metabolisme i intensivperioden, ettersom den nevroendokrine stressresponsen kan ha ulik varighet hos hver enkelt pasient (61). Ulikhetene hos intensivpasientene innebærer derfor en mulighet for at en ernæringsintervensjon forebygger ICUAW hos noen, samtidig som den øker risikoen for ICUAW hos andre. Utfordringen med den heterogene intensivpopulasjonen er også anerkjent i retningslinjer for ernæring til intensivpasienter (12,13). Både ASPEN (13) og ESPEN (12) understreker at heterogeniteten i intensivpopulasjonen kan svekke anbefalingenes eksterne validitet, slik at pasientens individuelle behov skal prioriteres foran å følge retningslinjene.
Flere peker på at ernæringsstudier med utfallsmål som fysisk funksjon og livskvalitet er et relativt nytt forskningsfelt som fremdeles er i utvikling (60,62). Fremtidige studier bør i større grad ta høyde for de metodologiske utfordringene som har åpenbart seg (60,62). Et eksempel på en studie som har gjort dette er studien til Wischmeyer et al. (53), hvor det er tatt høyde for aspekter ved intensivpopulasjonens heterogenitet og medfølgende ulike ernæringsbehov. Observasjonsstudier viser at undervektige og overvektige intensivpasienter har nytte av supplementell PN, mens normalvektige ikke har det. I Wischmeyer et al. (53) sin studie var derfor intervensjonen at overvektige og undervektige fikk suplementell PN mens normalvektige kun fikk standard EE (tabell 1). Studien var en pilotstudie som ikke hadde stort nok utvalg til å oppdage forskjeller i kliniske utfallsmål, men de fant en ikke-signifikant trend mot bedre resultat i intervensjonsgruppen (53).
For intensivsykepleiere i praksis, er det viktig å være klar over at betydningen av ernæring på utvikling av ICUAW er et område med fortsatt usikker evidens, preget av både få studier og metodologiske utfordringer. Resultatene i denne systematiske litteraturstudien kan derfor ikke anvendes til å endre eksisterende retningslinjer og anbefalinger. Videre forskning vil forhåpentligvis frembringe ny kunnskap, og dermed muligheter for endrede retningslinjer og anbefalinger for ernæring for å forebygge ICUAW.
Studiens begrensninger
I denne systematiske litteraturstudien er det gjort et omfattende litteratursøk med hensikt å inkludere alle utfallsmål som kan favnes av ICUAW. Likevel er det for få av studiene som er sammenlignbare som har god nok kvalitet til at det kan fastslås hvilken betydning ernæringen som gis under intensivforløpet har på utvikling av ICUAW. Kvalitetsvurderingen viste at studiene generelt har god kvalitet, men dette skyldes at studiene er vurdert ut fra sitt primærutfall. Utfallsmål som måler ICUAW var ofte sekundær- eller tertiærutfall i flere av studiene. Fem av studiene var også pilotstudier. Dette innebærer at flere av studiene ikke var designet for å finne effekt i en del av de relevante utfallsmålene for ICUAW (41,43,46,52,53). Dette medfører at en del av resultatene til studiene ikke har hatt stort nok utvalg og man vet derfor ikke om disse funnene skyldes tilfeldigheter. På grunn av designet på intervensjonene i studiene, har blinding vært en utfordring, og kun tre av studiene har full blinding (40,42,43). Dette innebærer at det er en viss risiko for systematiske skjevheter i studiene.
En utfordring i denne systematiske litteraturstudien er variasjonen i primærstudienes intervensjoner og utfallsmål. Heterogeniteten har gjort det vanskelig å sammenligne studier og sammenstille resultater. En svakhet med denne studien er at det ikke er publisert en prosjektbeskrivelse på forhånd. En styrke ved studien er at søket er kvalitetssikret av spesialbibliotekar, men studier kan ha blitt utelatt på grunn av annet språk enn engelsk eller skandinavisk.
Konklusjon
Denne systematiske litteraturstudien viser at det er motstridende resultater med hensyn til hvilken betydning ernæringen pasienten får under intensivforløpet har for utvikling av ICUAW. I de studiene som fant effekt av ernæringstiltak var effekten raskt avtagende, og ingen av studiene som undersøkte pasientenes fysiske funksjon etter utskrivelse fant effekt av ernæringsintervensjonene. Dessuten er det for få studier av god kvalitet til å fastslå betydningen av ulike ernæringstiltak på ICUAW. Fremtidige ernæringsstudier bør designes ut fra pasientenes individuelle behov, ettersom intensivpasienter vil ha varierende behov for ernæring både ut fra sitt utgangspunkt og om de har en pågående nevroendokrin stressrespons eller ikke. Det er også nødvendig at det utarbeides konsensus rundt hvilke endepunkter som er best egnet til å måle intensivoverleveres fysiske funksjon, slik at endepunktene som benyttes i studier er klinisk relevante og slik at resultater fra studier kan sammenstilles.
Referanser
- 1. Bear DE, Wandrag L, Merriweather JL, Connolly B, Hart N, Grocott MP. The role of nutritional support in the physical and functional recovery of critically ill patients: a narrative review. Crit Care. 2017;21(1):226.
- 2. Piva S, Fagoni N, Latronico N. Intensive care unit–acquired weakness: unanswered questions and targets for future research. F1000Res. 2019;8. https://doi.org/10.12688/f1000research.17376.1
- 3. Stevens RD, Marshall SA, R.Cornblath D, Hoke A, Needham DM, Jonghe Bd, et al. A framework for diagnosing and classifying intensive care unit-acquired weakness. Crit Care Med. 2009;37(10):S299-S308. https://doi.org/10.1097/CCM.0b013e3181b6ef67
- 4. Hermans G, Van den Berghe G. Clinical review: intensive care unit acquired weakness. Crit Care. 2015;19(1):274. https://doi.org/10.1186/s13054-015-0993-7
- 5. NSFLIS NFSs landsgruppe av intensivsykepleiere. Funksjons- og ansvarsbeskrivelse for intensivsykepleier. Oslo: Norsk Sykepleierforbund; 2017.
- 6. Puthucheary ZA, Rawal J, McPhail M, Connolly B, Ratnayake G, Chan P, et al. Acute skeletal muscle wasting in critical illness. JAMA: 2013;310(15):1591–600. https://doi.org/10.1001/jama.2013.278481
- 7. Sundström-Rehal M, Tardif N, Rooyackers O. Can exercise and nutrition stimulate muscle protein gain in the ICU patient? Curr Opin Clin Nutr Metab Care. 2019;22(2):146–51. https://doi.org/10.1097/MCO.0000000000000548
- 8. Lambell KJ, King SJ, Forsyth AK, Tierney AC. Association of energy and protein delivery on skeletal muscle mass changes in critically ill adults: a systematic review. JPEN J Parenter Enteral Nutr. 2018;42(7):1112–22. http://dx.doi.org/10.1002/jpen.1151
- 9. Latronico N, Herridge M, Hopkins R, Angus D, Hart N, Hermans G, et al. The ICM research agenda on intensive care unit-acquired weakness. Intens Care Med. 2017;43(9):1270–81. https://doi.org/10.1007/s00134-017-4757-5
- 10. Liu Y, Zhao W, Chen W, Shen X, Fu R, Zhao Y, et al. Effects of early enteral nutrition on immune function and prognosis of patients with sepsis on mechanical ventilation. J Intens Care Med. 2020;35(10):1053–61. https://doi.org/10.1177/0885066618809893
- 11. Yeh DD, Ortiz-Reyes LA, Quraishi SA, Chokengarmwong N, Avery L, Kaafarani HMA, et al. Early nutritional inadequacy is associated with psoas muscle deterioration and worse clinical outcomes in critically ill surgical patients. J Crit. 2018;45:7–13. http://dx.doi.org/10.1016/j.jcrc.2017.12.027
- 12. Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr. 2019;38(1):48–79. https://doi.org/10.1016/j.clnu.2018.08.037
- 13. McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). JPEN J Parenter Enter Nutr. 2016;40(2):159–211. https://doi.org/10.1177/0148607115621863
- 14. Yatabe T, Egi M, Sakaguchi M, Ito T, Inagaki N, Kato H, et al. Influence of nutritional management and rehabilitation on physical outcome in Japanese intensive care unit patients: a multicenter observational study. Ann Nutr Metab. 2019;74(1):35–43. https://dx.doi.org/10.1159/000495213
- 15. Fetterplace K, Beach LJ, MacIsaac C, Presneill J, Edbrooke L, Parry SM, et al. Associations between nutritional energy delivery, bioimpedance spectroscopy and functional outcomes in survivors of critical illness. J Hum Nutr Diet. 2019;32(6):702–12. https://dx.doi.org/10.1111/jhn.12659
- 16. Lad H, Saumur TM, Herridge MS, Dos Santos CC, Mathur S, Batt J, et al. Intensive Care Unit-Acquired Weakness: not just another muscle atrophying condition. Int. 2020;21(21):7840. https://doi.org/10.3390/ijms21217840
- 17. Fetterplace K, Ridley EJ, Beach L, Abdelhamid YA, Presneill JJ, MacIsaac CM, et al. Quantifying response to nutrition therapy during critical illness: implications for clinical practice and research? A narrative review. JPEN J Parenter Enteral Nutr. 2020;25:25. https://dx.doi.org/10.1002/jpen.1949
- 18. Ingvaldsen B. Væske, elektrolytter, blodgasser og infusjonsterapi. 5 utg. Oslo: Avdeling for anestesiologi Oslo universitetssykehus; 2016.
- 19. García-Martínez MÁ, González JCM, García-de-Lorenzo A, Teijeira S. Muscle weakness: understanding the principles of myopathy and neuropathy in the critically ill patient and the management options. Clin Nutr. 2019. https://doi.org/10.1016/j.clnu.2019.05.027
- 20. Stubberud D-G. Ernæring. I: Guldbrandsen T, Stubberud D-G, red. Intensivsykepleie. 3 utg. Oslo: Cappelen Damm Akademisk; 2016.
- 21. Trethewey SP, Brown N, Gao F, Turner AM. Interventions for the management and prevention of sarcopenia in the critically ill: a systematic review. J Critical Care. 2019;50:287–95. https://dx.doi.org/10.1016/j.jcrc.2019.01.008
- 22. Calvo-Ayala E, Khan BA, Farber MO, Ely EW, Boustani MA. Interventions to improve the physical function of ICU survivors: a systematic review. CHEST. 2013;144(5):1469–80. https://doi.org/10.1378/chest.13-0779
- 23. Bost RB, Tjan DH, van Zanten AR. Timing of (supplemental) parenteral nutrition in critically ill patients: a systematic review. Ann Intensive Care. 2014;4(1):1–13. https://doi.org/10.1186/s13613-014-0031-y
- 24. Fetterplace K, Gill BMT, Chapple LaS, Presneill JJ, MacIsaac C, Deane AM, et al. Systematic review with meta-analysis of patient-centered outcomes, comparing international guideline-recommended enteral protein delivery with usual care. JPEN J Parenter Enter Nutr. 2020;44(4):610–20. https://doi.org/10.1002/jpen.1725
- 25. Wandrag L, Brett SJ, Frost G, Hickson M. Impact of supplementation with amino acids or their metabolites on muscle wasting in patients with critical illness or other muscle wasting illness: a systematic review. J Hum Nutr Diet. 2015;28(4):313–30. http://dx.doi.org/10.1111/jhn.12238
- 26. Booth A, Sutton A, Papaioannou D. Systematic approaches to a successful literature review. 2. utg. London: Sage; 2016.
- 27. Grant MJ, Booth A. A typology of reviews: an analysis of 14 review types and associated methodologies. J Eur Assoc Health Inf Libr. 2009;26(2):91–108. https://doi.org/10.1111/j.1471-1842.2009.00848.x
- 28. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372.
- 29. Ouzzani M, Hammady H, Fedorowicz Z, Elmagarmid A. Rayyan—a web and mobile app for systematic reviews. Syst Rev. 2016;5(1):1–10. https://doi.org/10.1186/s13643-016-0384-4
- 30. Fleeman N, Dundar Y. Data extraction: Where do I begin? I: Cherry MG, Boland A, Dickson R, red. Doing a systematic review: a student’s guide. 2. utg. Thousand Oaks, Calif: Sage Publications; 2017. s. 93–106.
- 31. Critical Appraisal Skills Programme. CASP Randomised Controlled Trials Checklist. [Internett] 2019. Tilgjengelig fra: https://casp-uk.net/casp-tools-checklists/
- 32. Ghouri F, Hollywood A, Ryan K. A systematic review of non-antibiotic measures for the prevention of urinary tract infections in pregnancy. BMC Pregnancy Childbirth. 2018;18(1):99. https://doi.org/10.1186/s12884-018-1732-2
- 33. Brabant GV, Vasilevsky CA, Gardiner PA. Skeletal muscle function and the nutritional state. Surgical Forum. 1984;35:90–2.
- 34. Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G, et al. Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 2011;365(6):506–17. https://doi.org/10.1056/NEJMoa1102662
- 35. Van Dyck L, Derese I, Vander Perre S, Wouters PJ, Casaer MP, Hermans G, et al. The GH axis in relation to accepting an early macronutrient deficit and outcome of critically ill patients. J Clin Endicronol Metabol. 2019;104(11):5507–18. https://dx.doi.org/10.1210/jc.2019-00842
- 36. Hermans G, Casaer MP, Clerckx B, Guiza F, Vanhullebusch T, Derde S, et al. Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med. 2013;1(8):621–9. https://dx.doi.org/10.1016/S2213-2600(13)70183-8
- 37. Casaer MP, Langouche L, Coudyzer W, Vanbeckevoort D, De Dobbelaer B, Guiza FG, et al. Impact of early parenteral nutrition on muscle and adipose tissue compartments during critical illness. Crit Care Med. 2013;41(10):2298–309. https://dx.doi.org/10.1097/CCM.0b013e31828cef02
- 38. Needham DM, Dinglas VD, Morris PE, Jackson JC, Hough CL, Mendez-Tellez PA, et al. Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding EDEN Trial follow-up. Am J Respir Crit Care Med. 2013;188(5):567–76. http://dx.doi.org/10.1164/rccm.201304-0651OC
- 39. Needham DM, Dinglas VD, Bienvenu OJ, Colantuoni E, Wozniak AW, Rice TW, et al. One year outcomes in patients with acute lung injury randomised to initial trophic or full enteral feeding: prospective follow-up of EDEN randomised trial. BMJ. 2013;346:f1532. https://dx.doi.org/10.1136/bmj.f1532
- 40. Ferrie S, Allman-Farinelli M, Daley M, Smith K. Protein requirements in the critically ill: a randomized controlled trial using parenteral nutrition. JPEN J Parenter Enter Nutr. 2016;40(6):795–805. https://doi.org/10.1177/0148607115618449
- 41. Fetterplace K, Deane AM, Tierney A, Beach LJ, Knight LD, Presneill J, et al. Targeted full energy and protein delivery in critically ill patients: a pilot randomized controlled trial (FEED Trial). J Parenter Enter Nutr. 2018;42(8):1252–62. http://dx.doi.org/10.1002/jpen.1166
- 42. Deane AM, Little L, Bellomo R, Chapman MJ, Davies AR, Ferrie S, et al. Outcomes six months after delivering 100% or 70% of enteral calorie requirements during critical Illness (TARGET). A Randomized controlled trial. Am J Respir Crit Care Med. 2020;201(7):814–22. https://doi.org/10.1164/rccm.201909-1810OC
- 43. Reid DB, Chapple LS, O’Connor SN, Bellomo R, Buhr H, Chapman MJ, et al. The effect of augmenting early nutritional energy delivery on quality of life and employment status one year after ICU admission. Anaesth Intens Care. 2016;44(3):406–12. http://dx.doi.org/10.1177/0310057x1604400309
- 44. Doig GS, Simpson F, Sweetman EA, Finfer SR, Cooper DJ, Heighes PT, et al. Early parenteral nutrition in critically ill patients with short-term relative contraindications to early enteral nutrition: a randomized controlled trial. Jama. 2013;309(20):2130–8. https://dx.doi.org/10.1001/jama.2013.5124
- 45. Doig GS, Simpson F, Bellomo R, Heighes PT, Sweetman EA, Chesher D, et al. Intravenous amino acid therapy for kidney function in critically ill patients: a randomized controlled trial. Intens Care Med. 2015;41(7):1197–208. https://doi.org/10.1007/s00134-015-3827-9
- 46. Ridley EJ, Davies AR, Parke R, Bailey M, McArthur C, Gillanders L, et al. Supplemental parenteral nutrition versus usual care in critically ill adults: a pilot randomized controlled study. Crit Care. 2018;22:1-N.PAG. https://doi.org/10.1186/s13054-018-1939-7
- 47. Nakamura K, Kihata A, Naraba H, Kanda N, Takahashi Y, Sonoo T, et al. b-Hydroxy-b-methylbutyrate, arginine, and glutamine complex on muscle volume loss in critically ill patients: a randomized control trial. JPEN J Parenter Enter Nutr. 2020;44(2):205–12. https://doi.org/10.1002/jpen.1607
- 48. Berger MM, Pantet O, Jacquelin-Ravel N, Charrière M, Schmidt S, Becce F, et al. Supplemental parenteral nutrition improves immunity with unchanged carbohydrate and protein metabolism in critically ill patients: the SPN2 randomized tracer study. Clin Nutr. 2019;38(5):2408–16.
- 49. McNelly AS, Bear DE, Connolly BA, Arbane G, Allum L, Tarbhai A, et al. Effect of intermittent or continuous feed on muscle wasting in critical illness: a phase 2 clinical trial. Chest. 2020;158(1):183–94. https://dx.doi.org/10.1016/j.chest.2020.03.045
- 50. Dresen E, Weißbrich C, Fimmers R, Putensen C, Stehle P. Medical high-protein nutrition therapy and loss of muscle mass in adult ICU patients: A randomized controlled trial. Clin Nutr. 2021;40(4):1562–70. https://doi.org/10.1016/j.clnu.2021.02.021
- 51. Allingstrup MJ, Kondrup J, Wiis J, Claudius C, Pedersen UG, Hein-Rasmussen R, et al. Early goal-directed nutrition versus standard of care in adult intensive care patients: the single-centre, randomised, outcome assessor-blinded EAT-ICU trial. Intens Care Med. 2017;43(11):1637–47. https://doi.org/10.1007/s00134-017-4880-3
- 52. Vega-Alava KM, Sy RAG, Domado AM. The effect of whey protein supplementation on duration of mechanical ventilation: A pilot study. Philipp J Intern Med. 2018;56(2):71–6.
- 53. Wischmeyer PE, Hasselmann M, Kummerlen C, Kozar R, Kutsogiannis DJ, Karvellas CJ, et al. A randomized trial of supplemental parenteral nutrition in underweight and overweight critically ill patients: the TOP-UP pilot trial. Crit Care. 2017;21:1–14. https://doi.org/10.1186/s13054-017-1736-8
- 54. Coster WJ. Making the best match: selecting outcome measures for clinical trials and outcome studies. Am J Occup Ther. 2013;67(2):162–70. https://doi.org/10.5014/ajot.2013.006015
- 55. Aitken LM, Burmeister E, McKinley S, Alison J, King M, Leslie G, et al. Physical recovery in intensive care unit survivors: a cohort analysis. Am J Crit Care. 2015;24(1):33–40. https://doi.org/10.4037/ajcc2015870
- 56. Hashem MD, Nallagangula A, Nalamalapu S, Nunna K, Nausran U, Robinson KA, et al. Patient outcomes after critical illness: A systematic review of qualitative studies following hospital discharge. Crit Care. 2016;20(1). http://dx.doi.org/10.1186/s13054-016-1516-x
- 57. Taverny G, Lescot T, Pardo E, Thonon F, Maarouf M, Alberti C. Outcomes used in randomised controlled trials of nutrition in the critically ill: A systematic review. Criti Care. 2019;23(1). http://dx.doi.org/10.1186/s13054-018-2303-7
- 58. Marik PE, Hooper MH. Normocaloric versus hypocaloric feeding on the outcomes of ICU patients: a systematic review and meta-analysis. Intens Care Med. 2016;42(3):316–23. https://doi.org/10.1007/s00134-015-4131-4
- 59. Davies ML, Chapple L-AS, Chapman MJ, Moran JL, Peake SL. Protein delivery and clinical outcomes in the critically ill: a systematic review and meta-analysis. Crit Care Resusc. 2017;19(2):117.
- 60. Bear DE, Puthucheary ZA. Designing nutrition-based interventional trials for the future: addressing the known knowns. Crit Care. 2019;23(1):53. https://dx.doi.org/10.1186/s13054-019-2345-5
- 61. Arabi YM, Casaer MP, Chapman M, Heyland DK, Ichai C, Marik PE, et al. The intensive care medicine research agenda in nutrition and metabolism. Intens Care Med. 2017;43(9):1239–56. https://doi.org/10.1007/s00134-017-4711-6
- 62. Chapple L-aS, Ridley EJ, Chapman MJ. Trial design in critical care nutrition: the past, present and future. Nutrients. 2020;12(12):3694. https://doi.org/10.3390/nu12123694